题目内容
建构数学模型来研究化学问题,既直观又简洁.下列建构的数轴模型正确的是( )
A、钠在氧气中燃烧,钠的氧化产物: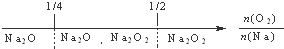 |
B、铁在Cl2中燃烧,铁的氧化产物: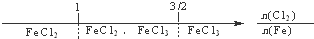 |
C、NH3与Cl2反应,反应产物: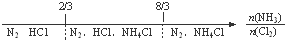 |
D、FeBr2溶液中通入Cl2,铁元素存在形式: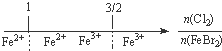 |
考点:钠的化学性质,氯气的化学性质,氨的化学性质,铁的化学性质
专题:元素及其化合物
分析:A、钠在氧气中燃烧,只生成过氧化钠;
B、铁在Cl2中燃烧,只生成氯化铁;
C、NH3与Cl2反应,氨气少量2NH3+3Cl2=6HCl+N2,氨气过量8NH3+3Cl2=N2+6NH4Cl;
D、因还原性:Fe2+>Br-,氯气先氧化Fe2+,再氧化Br-,向FeBr2溶液中通入少量Cl2,只发生Cl2+2Fe2+═2Fe3++2Cl-,所以两者之比为
时,亚铁离子全部被氧化.
B、铁在Cl2中燃烧,只生成氯化铁;
C、NH3与Cl2反应,氨气少量2NH3+3Cl2=6HCl+N2,氨气过量8NH3+3Cl2=N2+6NH4Cl;
D、因还原性:Fe2+>Br-,氯气先氧化Fe2+,再氧化Br-,向FeBr2溶液中通入少量Cl2,只发生Cl2+2Fe2+═2Fe3++2Cl-,所以两者之比为
| 1 |
| 2 |
解答:
解:A、钠在氧气中燃烧,只生成过氧化钠,故A错误;
B、铁在Cl2中燃烧,只生成氯化铁,故B错误;
C、NH3与Cl2反应,氨气少量2NH3+3Cl2=6HCl+N2,氨气过量8NH3+3Cl2=N2+6NH4Cl,所以两者之比为
时,恰好完全反应生成HCl和N2,两者之比为
时,恰好完全反应生成NH4Cl和N2,故C正确;
D、因还原性:Fe2+>Br-,氯气先氧化Fe2+,再氧化Br-,向FeBr2溶液中通入少量Cl2,只发生Cl2+2Fe2+═2Fe3++2Cl-,所以两者之比为
时,亚铁离子全部被氧化,故D错误;
故选C.
B、铁在Cl2中燃烧,只生成氯化铁,故B错误;
C、NH3与Cl2反应,氨气少量2NH3+3Cl2=6HCl+N2,氨气过量8NH3+3Cl2=N2+6NH4Cl,所以两者之比为
| 2 |
| 3 |
| 8 |
| 3 |
D、因还原性:Fe2+>Br-,氯气先氧化Fe2+,再氧化Br-,向FeBr2溶液中通入少量Cl2,只发生Cl2+2Fe2+═2Fe3++2Cl-,所以两者之比为
| 1 |
| 2 |
故选C.
点评:本题考查了元素化合物的知识,D选项要熟悉碘离子、溴离子、二价铁离子还原性强弱顺序为解体关键,题目难度中等.

练习册系列答案
相关题目
下列与有机物的结构、性质相关的叙述错误的是( )
| A、分子式为C5H12的烃有三种可能的结构 |
| B、乙醇分子中含有羟基,可以和金属Na反应生成H2 |
| C、苯不能使溴的四氯化碳溶液褪色,说明苯分子中没有与乙烯分子中相似的碳碳双键 |
| D、淀粉、蛋白质、油脂、葡萄糖在一定条件下均能发生水解反应 |
生产生活离不开化学,下列有关说法,你的判断是( )
①“白雪牌”漂粉精可令所有有色物质黯然失“色”,没有最白,只有更白
②“农夫山泉”天然矿泉水不含任何化学物质
③人喝了啤酒会打嗝,是因为啤酒中的碳酸盐与胃酸反应生成了二氧化碳
④53度白酒是指乙醇的质量分数为53%
⑤“碳纳米泡沫”是一种纯碳新材料,每个泡沫直径约6到9nm,该材料能产生丁达尔现象
⑥“静心”口服液含丰富的氮、磷、锌等微量元素.
①“白雪牌”漂粉精可令所有有色物质黯然失“色”,没有最白,只有更白
②“农夫山泉”天然矿泉水不含任何化学物质
③人喝了啤酒会打嗝,是因为啤酒中的碳酸盐与胃酸反应生成了二氧化碳
④53度白酒是指乙醇的质量分数为53%
⑤“碳纳米泡沫”是一种纯碳新材料,每个泡沫直径约6到9nm,该材料能产生丁达尔现象
⑥“静心”口服液含丰富的氮、磷、锌等微量元素.
| A、全都正确 |
| B、只有⑤正确 |
| C、只有④⑤正确 |
| D、以上说法都是错误的 |
常温下,若等物质的量浓度的HA溶液和NaOH溶液混合后pH=7,下列说法合理的是( )
| A、反应后HA溶液一定没有剩余 |
| B、生成物NaA的水溶液的pH可能小于7 |
| C、HA溶液和NaOH溶液的体积可能不相等 |
| D、HA溶液的c(H+)和NaOH溶液的c(OH-)一定相等 |
用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A、17g-OH(羟基)所含电子总数为9NA |
| B、标准状况下,22.4LCHCl3中所含分子数为NA |
C、32g S8单质(结构如图)中含有的S-S键个数为2NA |
| D、18gD2O中含有的原子数为3NA |
化学与生产、生活密切相关.下列叙述正确的是( )
| A、SiO2制成的玻璃纤维,由于导电能力强而被用于制造通讯光缆 |
| B、处理废水时加入明矾作为消毒剂可以除去水中的杂质 |
| C、为防止电池中的重金属污染,应积极开发废电池的综合利用技术并研发新型电池 |
| D、某雨水样品放置一段时间后pH由4.68变为4.28,是因为雨水中溶解了较多的CO2 |
如表是食用碘盐包装上的部分说明,下列说法正确的是( )
| 配料 | 精盐、碘酸钾、抗结剂 |
| 碘含量 | 35±15mg?kg-1 |
| 储存方法 | 密封、避光、防潮 |
| 食用方法 | 烹饪时,待食品熟后加入碘盐 |
| A、高温会导致碘的损失 |
| B、碘酸钾可氧化氯化钠 |
| C、可用淀粉检验碘盐中的碘酸钾 |
| D、该碘盐中碘酸钾含量为20~50 mg?kg-1 |
化学在生产和日常生活中有着重要的应用.下列叙述正确的是( )
| A、盐酸滴定氨水,可以选择酚酞为指示剂 |
| B、电离程度(同温度同浓度溶液中):HCl>CH3OOH>NaHCO3 |
| C、分散质粒子的直径:FeCl3溶液>Fe(OH)3胶体>Fe(OH)3悬浊液 |
| D、若要使Na2S溶液中c(Na+)/c(S2-)的值减小,可以加入适量的KOH固体 |
将m g铁粉放入含有x mol FeCl3和y molCuCl2的混合溶液中,充分反应后,固体质量仍为m g.则x:y可能是( )
| A、2:7 | B、1:7 |
| C、8:7 | D、1:1 |