题目内容
化学在生产和日常生活中有着重要的应用.下列叙述正确的是( )
| A、盐酸滴定氨水,可以选择酚酞为指示剂 |
| B、电离程度(同温度同浓度溶液中):HCl>CH3OOH>NaHCO3 |
| C、分散质粒子的直径:FeCl3溶液>Fe(OH)3胶体>Fe(OH)3悬浊液 |
| D、若要使Na2S溶液中c(Na+)/c(S2-)的值减小,可以加入适量的KOH固体 |
考点:电解质在水溶液中的电离,分散系、胶体与溶液的概念及关系,盐类水解的原理,中和滴定
专题:
分析:A.氯化铵溶液显酸性;
B.NaHCO3在溶液中完全电离;
C.悬浊液中微粒的直径最大,溶液中微粒的直径最小;
D.根据S2-的水解平衡移动分析.
B.NaHCO3在溶液中完全电离;
C.悬浊液中微粒的直径最大,溶液中微粒的直径最小;
D.根据S2-的水解平衡移动分析.
解答:
解:A.盐酸滴定氨水,反应产物为氯化铵,氯化铵溶液显酸性,所以应该选甲基橙为指示剂,故A错误;
B.NaHCO3在溶液中完全电离,CH3OOH部分电离,则电离程度(同温度同浓度溶液中):HCl=NaHCO3>CH3OOH,故B错误;
C.悬浊液中微粒的直径最大,溶液中微粒的直径最小,则分散质粒子的直径:FeCl3溶液<Fe(OH)3胶体<Fe(OH)3悬浊液,故C错误;
D.在硫化钠溶液中电离出钠离子和硫离子,硫离子水解方程式为:S2-+H2O?HS-+OH-,要使钠离子和硫离子浓度比值减小,需使硫离子水解平向逆方向移动即可,加适量KOH溶液,平衡向着逆向移动,使得S2-的物质的量增大,而钠离子的物质的量不变,则比值减小,故D正确.
故选D.
B.NaHCO3在溶液中完全电离,CH3OOH部分电离,则电离程度(同温度同浓度溶液中):HCl=NaHCO3>CH3OOH,故B错误;
C.悬浊液中微粒的直径最大,溶液中微粒的直径最小,则分散质粒子的直径:FeCl3溶液<Fe(OH)3胶体<Fe(OH)3悬浊液,故C错误;
D.在硫化钠溶液中电离出钠离子和硫离子,硫离子水解方程式为:S2-+H2O?HS-+OH-,要使钠离子和硫离子浓度比值减小,需使硫离子水解平向逆方向移动即可,加适量KOH溶液,平衡向着逆向移动,使得S2-的物质的量增大,而钠离子的物质的量不变,则比值减小,故D正确.
故选D.
点评:本题考查了电解质的电离、盐的水解平衡移动、分散系等,题目难度不大,侧重于基础知识的考查,注意把握盐的水解平衡移动的影响因素.

练习册系列答案
 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案
相关题目
建构数学模型来研究化学问题,既直观又简洁.下列建构的数轴模型正确的是( )
A、钠在氧气中燃烧,钠的氧化产物: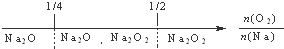 |
B、铁在Cl2中燃烧,铁的氧化产物: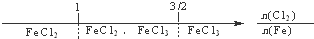 |
C、NH3与Cl2反应,反应产物: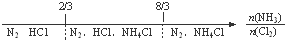 |
D、FeBr2溶液中通入Cl2,铁元素存在形式: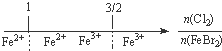 |
下列各组离子在强酸性条件下可以大量共存的是( )
| A、Cu2+、SO42-、CH3COO-、Cl- |
| B、K+、Na+、NO3-、Ba2+ |
| C、SO42-、Ba2+、Cl-、AlO2- |
| D、Mg2+、Na+、S2-、SO42- |
下列物质中,不属于电解质的是( )
| A、H2SO4 |
| B、AgCl |
| C、NaOH |
| D、酒精 |
对于下列各组反应,反应开始时,产生氢气速率最快的是( )
| A、70℃,将0.1 mol 镁粉加入到10 mL 6 mol?L-1 的硝酸溶液中 |
| B、60℃,将0.2 mol 镁粉加入到20 mL 3 mol?L-1 的盐酸溶液中 |
| C、60℃,将0.1 mol 镁粉加入到10 mL 3 mol?L-1 的硫酸溶液中 |
| D、60℃,将0.2 mol 铁粉加入到10 mL 3 mol?L-1 的盐酸溶液中 |
标况下气体的体积大小主要取决于( )
| A、分子数目 | B、分子间距 |
| C、分子大小 | D、分子种类 |
已知氧化性强弱顺序:Cl2>Br2>Fe3+>I2.下列反应不能发生的是( )
| A、Br2+2I-=I2+2 Br- |
| B、2FeCl2+Cl2=2FeCl3 |
| C、2FeCl2+2HCl+I2=2FeCl3+2HI |
| D、2Fe3++2I-=2Fe2++I2 |
 已知溶液中:还原性HSO3->I-,氧化性IO3->I2>SO42-.向含3mol NaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如图所示.
已知溶液中:还原性HSO3->I-,氧化性IO3->I2>SO42-.向含3mol NaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如图所示.