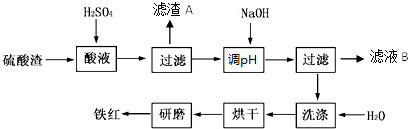
题目内容
化学与生产、生活密切相关.下列叙述正确的是( )
| A、SiO2制成的玻璃纤维,由于导电能力强而被用于制造通讯光缆 |
| B、处理废水时加入明矾作为消毒剂可以除去水中的杂质 |
| C、为防止电池中的重金属污染,应积极开发废电池的综合利用技术并研发新型电池 |
| D、某雨水样品放置一段时间后pH由4.68变为4.28,是因为雨水中溶解了较多的CO2 |
考点:常见的生活环境的污染及治理,硅和二氧化硅
专题:化学应用
分析:A.SiO2制成的玻璃纤维,被用于制造通讯光缆与导电能力强弱无关;
B.根据明矾净水的原理:加入水中形成的胶状物,对杂质的吸附使之沉淀;
C.重金属有毒,电池中含有铅、镉等重金属;
D.酸雨中亚硫酸为弱电解质,具有还原性,能被氧化成强电解质硫酸,溶液的pH减小.
B.根据明矾净水的原理:加入水中形成的胶状物,对杂质的吸附使之沉淀;
C.重金属有毒,电池中含有铅、镉等重金属;
D.酸雨中亚硫酸为弱电解质,具有还原性,能被氧化成强电解质硫酸,溶液的pH减小.
解答:
解:A.二氧化硅具有良好的导光性,则用于制造通讯光缆,与导电能力强弱无关,故A错误;
B.明矾净水的原理是加入水中形成的胶状物,对杂质的吸附使之沉淀,不是作为消毒剂,故B错误;
C.因废电池中铅、镉、汞等重金属对土壤和水源的污染非常严重,所以应积极开发 废电池的综合利用技术,减少土壤和水源的污染,故C正确;
D.饱和CO2溶液的PH等于5.6,而雨水的pH由4.68变为4.28,是由于2H2SO3+O2═2H2SO4,溶液的酸性增强,pH减小,故D错误;
故选C.
B.明矾净水的原理是加入水中形成的胶状物,对杂质的吸附使之沉淀,不是作为消毒剂,故B错误;
C.因废电池中铅、镉、汞等重金属对土壤和水源的污染非常严重,所以应积极开发 废电池的综合利用技术,减少土壤和水源的污染,故C正确;
D.饱和CO2溶液的PH等于5.6,而雨水的pH由4.68变为4.28,是由于2H2SO3+O2═2H2SO4,溶液的酸性增强,pH减小,故D错误;
故选C.
点评:本题考查了化学知识在生活实际的应用,熟悉二氧化硅导光性、明矾的净水作用、废旧电池回收、酸雨成分等即可解答,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列实验操作中正确的是( )
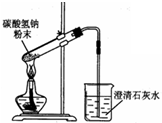

| A、用如图装置加热碳酸氢钠粉末 |
| B、蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 |
| C、过滤时,若发现滤液浑浊,应更换滤纸,重新过滤 |
| D、制备Fe(OH)3胶体是向盛有沸水的烧杯中滴加FeCl3饱和溶液并长时间煮沸 |
实验室制Cl2?时有如下操作:①连好装置,检查器密性;②缓缓加热;③加入MnO2?粉末; ④从装有浓盐酸的分液漏斗中加入浓盐酸;⑤将多余氧气用NaOH溶液吸收;⑥用向上排气收集氯气.顺序正确的是( )
| A、①②③④⑥⑤ |
| B、③④②①⑥⑤ |
| C、①④③②⑥⑤ |
| D、①③④②⑥⑤ |
下列各物质投入水中,因促进水的电离而使溶液呈碱性的是( )
| A、NaOH |
| B、NH3 |
| C、CH3COONa |
| D、NH4Cl |
建构数学模型来研究化学问题,既直观又简洁.下列建构的数轴模型正确的是( )
A、钠在氧气中燃烧,钠的氧化产物: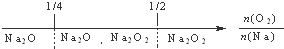 |
B、铁在Cl2中燃烧,铁的氧化产物: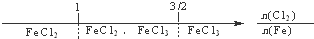 |
C、NH3与Cl2反应,反应产物: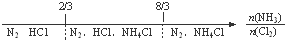 |
D、FeBr2溶液中通入Cl2,铁元素存在形式: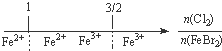 |
下列各组离子在强酸性条件下可以大量共存的是( )
| A、Cu2+、SO42-、CH3COO-、Cl- |
| B、K+、Na+、NO3-、Ba2+ |
| C、SO42-、Ba2+、Cl-、AlO2- |
| D、Mg2+、Na+、S2-、SO42- |
下列物质中,不属于电解质的是( )
| A、H2SO4 |
| B、AgCl |
| C、NaOH |
| D、酒精 |
下列指定粒子的数目相等的是( )
| A、物质的量相等的水与重水含有的中子数 |
| B、等质量的氧气和臭氧中含有的氧原子数 |
| C、同温、同压、同体积的一氧化碳和乙烯含有的质子数 |
| D、等物质的量的钠和铜分别与氧气完全反应,转移的电子数 |