题目内容
7.下列离子方程式书写正确的是( )| A. | 漂白粉溶液中通入过量的CO2:Ca2++2ClO-+CO2+H2O═CaCO3↓+2HClO | |
| B. | 氯气与水的反应:Cl2+H2O═2H++Cl-+ClO- | |
| C. | NaHCO3溶液中加足量Ba(OH)2溶液:HCO3-+Ba2++OH-═BaCO3↓+H2O | |
| D. | 钠和冷水反应:Na+2H2O═Na++2OH?+H2↑ |
分析 A.二氧化碳过量,反应生成碳酸氢钙;
B.次氯酸为弱电解质,应保留化学式;
C.二者反应生成碳酸钡和氢氧化钠和水;
D.电荷不守恒.
解答 解:A.向漂白粉溶液中通入过量的CO2,离子方程式为:ClO-+CO2+H2O═HClO+HCO3-,故A错误;
B.氯气与水的反应,离子方程式:Cl2+H2O═H++Cl-+HClO,故B错误;
C.NaHCO3溶液中加足量Ba(OH)2溶液:HCO3-+Ba2++OH-═BaCO3↓+H2O,故C正确;
D.钠和冷水反应,离子方程式:2Na+2H2O═2Na++2OH?+H2↑,故D错误;
故选:C.
点评 本题考查了离子方程式的书写,明确反应实质及离子方程式书写方法是解题关键,注意化学式的拆分、原子个数、电荷数守恒,题目难度不大.

练习册系列答案
 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案
相关题目
17.下列化学反应中,既是置换反应又是氧化还原反应的是( )
| A. | 2Al+6HCl═2 AlCl3+3H2 | B. | 4Na+O2═2Na2O | ||
| C. | MgO+H2SO4═MgSO4+2H2O | D. | Ba(OH)2+H2SO4═BaSO4↓+2H2O |
15.若NA表示阿伏加德罗常数,下列关于0.3mol/L的MgCI2溶液的说法正确的是( )
| A. | 100毫升的溶液中含有Mg2+、CI-总数为0.3 NA | |
| B. | 100毫升的溶液中含有Mg2+数目是O.1NA | |
| C. | 2升溶液中Mg2+的浓度是0.3mol/L | |
| D. | 1.5升溶液中含有CI-的浓度是4.5mol/L |
2.如图是某燃煤发电厂处理废气的装置示意图,下列说法错误的是( )
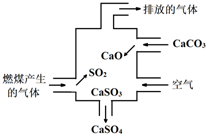

| A. | 使用此装置可减少导致酸雨的气体形成 | |
| B. | 用酸性高锰酸钾溶液检验废气处理是否达标 | |
| C. | 整个过程的总反应可表示为:2SO2+2CaCO3+O2=2CaSO4+2CO2 | |
| D. | 排放的气体是纯净物 |
19.下列化学式可表示一个分子的是( )
| A. | SiO2 | B. | NH4Cl | C. | CCl4 | D. | C |
16.下列各组离子在溶液中可以大量共存,当溶液呈强酸性时,有气体产生;而当溶液呈强碱性时,又能生成沉淀.该组离子可能是( )
| A. | Na+、Cu2+、NO3-、CO32- | B. | NH4+、K+、SO42-、HCO3- | ||
| C. | Mg2+、NH4+、SO42-、Cl- | D. | Fe2+、Na+、SO42-、NO3- |
13.下列说法正确的是( )
| A. | 已知C2H6的燃烧热为1090 kJ•mol-1,则C2H6燃烧的热化学方程式为:C2H6(g)+3.5O2(g)═2CO2(g)+3H2O(g)△H=-1090 kJ/mol | |
| B. | 已知2CO(g)+O2(g)═2CO2(g)△H=-566 kJ•mol-1,则CO的燃烧热△H=-283 kJ | |
| C. | HCl和NaOH反应的中和热时,每次实验均应测量3个温度即盐酸起始温度、NaOH起始温度和反应后终止温度 | |
| D. | 在稀溶液中:H+(aq)+OH-(aq)=H2O(l)△H=-57.3KJ/mol,则稀醋酸与稀NaOH溶液反应生成1 mol H2O(l)时也放出57.3 kJ的热量 |