题目内容
19.下列化学式可表示一个分子的是( )| A. | SiO2 | B. | NH4Cl | C. | CCl4 | D. | C |
分析 化学式能真实表示物质分子组成的是分子晶体,常见的分子晶体有:所有非金属氢化物、部分非金属单质(金刚石、晶体硅等除外)、部分非金属氧化物(二氧化硅等除外)、几乎所有的酸、绝大多数的有机物晶体,以此解答.
解答 解:A.SiO2为原子晶体,晶体是由硅原子和氧原子以共价键构成的空间网状结构,没有SiO2分子,故A错误;
B.NH4Cl为离子晶体,晶体中阴、阳离子的个数比为1:1,没有NH4Cl分子,故B错误;
C.CCl4是分子晶体,晶体中只存在分子,所以CCl4可表示一个分子,故C正确;
D.C为原子晶体,是由碳原子和碳原子以共价键构成的空间网状结构,没有C分子,故D错误;
故选C.
点评 本题主要考查分子晶体类型的判断,掌握常见物质晶体类型及常见分子晶体是解答的关键,题目难度不大.主要稀有气体为单原子分子.

练习册系列答案
 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案
相关题目
9.已知下列物质都可以将盐酸氧化成Cl2,并发生如下还原反应:
MnO4-→Mn2+; ClO3-→Cl2; MnO2→Mn2+; ClO-→Cl2;等物质的量的下列化合物与足量浓盐酸反应,得到Cl2的物质的量最少的是( )
MnO4-→Mn2+; ClO3-→Cl2; MnO2→Mn2+; ClO-→Cl2;等物质的量的下列化合物与足量浓盐酸反应,得到Cl2的物质的量最少的是( )
| A. | KClO3 | B. | KMnO4 | C. | MnO2 | D. | Ca(ClO)2 |
7.下列离子方程式书写正确的是( )
| A. | 漂白粉溶液中通入过量的CO2:Ca2++2ClO-+CO2+H2O═CaCO3↓+2HClO | |
| B. | 氯气与水的反应:Cl2+H2O═2H++Cl-+ClO- | |
| C. | NaHCO3溶液中加足量Ba(OH)2溶液:HCO3-+Ba2++OH-═BaCO3↓+H2O | |
| D. | 钠和冷水反应:Na+2H2O═Na++2OH?+H2↑ |
14.只用一种试剂就能将甲苯、己烯、四氯化碳、碘化钾溶液区分开,该试剂可以是( )
| A. | 酸性高锰酸钾溶液 | B. | 溴化钾溶液 | ||
| C. | 溴水 | D. | 硝酸银溶液 |
4.某烃的结构简式为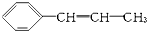 ,它可能具有的性质是( )
,它可能具有的性质是( )
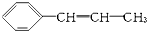 ,它可能具有的性质是( )
,它可能具有的性质是( )| A. | 易溶于水,也易溶于有机溶剂 | |
| B. | 既能使溴水褪色,又能使酸性KMnO4溶液褪色 | |
| C. | 能发生聚合反应,其产物可表示为 | |
| D. | 能使溴水褪色,但不能使酸性KMnO4溶液褪色 |
11.在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)?CO(g)+H2O(g),其化学平衡常数K与温度t的关系如下:
请回答下列问题:
(1)该反应的化学平衡常数表达式K=$\frac{c(CO)•c(H{\;}_{2}O)}{c(CO{\;}_{2})•c(H{\;}_{2})}$.
(2)该反应为吸热反应(填“吸热”或“放热”),升高温度,逆反应速率增大(填“增大”、“减小”或“不变”)
(3)温度不变,减小CO浓度,平衡向正反应方向移动(填“正反应”或“逆反应”),该反应平衡常数K 值不变(填“增大”、“减小”或“不变”)
(4)800℃时,固定容积的密闭容器中放入混合物,起始浓度为c(CO)=1mol•L-1,c(H2O)=3mol•L-1,c(CO2)=1mol•L-1,c(H2)=5mol•L-1,则反应开始时,H2O的消耗速率比生成速率小(填“大”、“小”或“不能确定”)
(5)t℃时,在2L的固定容积的密闭容器中放入4mol CO2和6mol H2,平衡后CO2的转化率为60%,则达到平衡时CO的体积分数为24%,反应温度t为830℃.
温度不变,若起始时投入3.6mol CO、3.6mol H2O和1.8mol H2,则达到平衡时CO的体积分数为24%,H2的平衡浓度为1.62mol/L.
| T/℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应的化学平衡常数表达式K=$\frac{c(CO)•c(H{\;}_{2}O)}{c(CO{\;}_{2})•c(H{\;}_{2})}$.
(2)该反应为吸热反应(填“吸热”或“放热”),升高温度,逆反应速率增大(填“增大”、“减小”或“不变”)
(3)温度不变,减小CO浓度,平衡向正反应方向移动(填“正反应”或“逆反应”),该反应平衡常数K 值不变(填“增大”、“减小”或“不变”)
(4)800℃时,固定容积的密闭容器中放入混合物,起始浓度为c(CO)=1mol•L-1,c(H2O)=3mol•L-1,c(CO2)=1mol•L-1,c(H2)=5mol•L-1,则反应开始时,H2O的消耗速率比生成速率小(填“大”、“小”或“不能确定”)
(5)t℃时,在2L的固定容积的密闭容器中放入4mol CO2和6mol H2,平衡后CO2的转化率为60%,则达到平衡时CO的体积分数为24%,反应温度t为830℃.
温度不变,若起始时投入3.6mol CO、3.6mol H2O和1.8mol H2,则达到平衡时CO的体积分数为24%,H2的平衡浓度为1.62mol/L.
8.我国卫生部门制定的《关于宣传吸烟有毒与控制吸烟》的通知中规定:“中学生不准吸烟”.香烟燃烧产生的烟气中,有多种有害物质,其中尼古丁(C10H14N2)对人体危害最大,下列说法正确的是( )
| A. | 尼古丁是由26个原子构成的物质 | |
| B. | 尼古丁中C、H、N 三种元素的质量比为:10:14:2 | |
| C. | 尼古丁的相对分子质量是162g | |
| D. | 尼古丁中氮元素的质量分数为17.3% |
5.下列变化中,属于化学变化的是( )
| A. | 氯水光照后褪色 | B. | 溴挥发 | ||
| C. | 碘升华 | D. | 溴水加CCl4后溴水层褪色 |
