题目内容
短周期元素A、B、C、D、E的原子序数依次增大,其元素特征信息如下表:
(1)E的简单离子的结构示意图为 ;
(2)A常见单质的电子式 ;
(3)D在周期表中的位置为 ;
(4)B和C简单离子的半径大小为 > ;(用离子符号表示)
(5)下列比较B和E的非金属性强弱的研究方案不可行的是 (填序号);
a.比较两种单质的颜色 b.比较氢化物的稳定性
c.依据两元素在周期表中的位置 d.依据两元素单质在自然界中的存在状态
(6)用电子式表示C和E形成化合物的过程 .
(7)B和C形成的既含有离子键又含有非极性键的物质是 (用电子式表示),
(8)E的最高价氧化物的水化物与D的最高价氧化物的水化物反应的离子方程式为 .
| 元素编号 | 元素特征信息 |
| A | 最高正价和最低负价的绝对值之差为2 |
| B | 最外层电子数是内层电子数的3倍 |
| C | 1mol C单质能与冷水反应,在标准状况下生产11.2L H2 |
| D | 原子最外层电子数等于其周期序数 |
| E | 负二价阴离子的电子层结构与Ar原子相同 |
(2)A常见单质的电子式
(3)D在周期表中的位置为
(4)B和C简单离子的半径大小为
(5)下列比较B和E的非金属性强弱的研究方案不可行的是
a.比较两种单质的颜色 b.比较氢化物的稳定性
c.依据两元素在周期表中的位置 d.依据两元素单质在自然界中的存在状态
(6)用电子式表示C和E形成化合物的过程
(7)B和C形成的既含有离子键又含有非极性键的物质是
(8)E的最高价氧化物的水化物与D的最高价氧化物的水化物反应的离子方程式为
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:短周期元素A、B、C、D、E的原子序数依次增大,A的最高正价和最低负价的绝对值之差为2,则A的最高正价为+5,负价为-3,所以A为N;B的最外层电子数是内层电子数的3倍,最外层电子数为6,则B为O;1molC单质能与冷水反应,在标准状况下生成11.2LH2,哦也C为Na;D的原子最外层电子数等于其周期序数,即D为第三周期第ⅢA族元素,所以D为Al;E的负二价阴离子的电子层结构与Ar原子相同,其质子数为18-2=16,所以E为S,结合化学用语及元素周期律来解答.
解答:
解:短周期元素A、B、C、D、E的原子序数依次增大,A的最高正价和最低负价的绝对值之差为2,则A的最高正价为+5,负价为-3,所以A为N;B的最外层电子数是内层电子数的3倍,最外层电子数为6,则B为O;1molC单质能与冷水反应,在标准状况下生成11.2LH2,哦也C为Na;D的原子最外层电子数等于其周期序数,即D为第三周期第ⅢA族元素,所以D为Al;E的负二价阴离子的电子层结构与Ar原子相同,其质子数为18-2=16,所以E为S,
(1)E为硫元素,它的简单离子的结构示意图为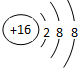 ,故答案为:
,故答案为: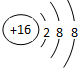 ;
;
(2)A的常见单质为氮气,它的电子式为 ,故答案为:
,故答案为: ;
;
(3)D为铝元素,位于第三周期第ⅢA族元素,故答案为:第三周期IIIA族;
(4)B和C简单离子具有相同的电子排布,原子序数大的离子半径小,则离子半径为O2->Na+,故答案为:O2->Na+;
(5)不能利用物理性质(如颜色、状态)来比较非金属性,也不能根据单质在自然界中的存在状态判断非金属性的强弱,可利用氢化物的稳定性或元素在周期表的位置等来比较非金属性,故答案为:ad;
(6)C和E形成的化合物是硫化钠,用电子式表示它的形成过程为 ,故答案为:
,故答案为: ;
;
(7)B和C形成的既含有离子键又含有非极性键的物质是Na2O2,它的电子式为 ,故答案为:
,故答案为: ;
;
(8)E的最高价氧化物的水化物是硫酸,D的最高价氧化物的水化物是氢氧化铝,它们反应的离子方程式为Al(OH)3+3H+=Al3++3H2O,故答案为:Al(OH)3+3H+=Al3++3H2O;
(1)E为硫元素,它的简单离子的结构示意图为
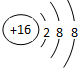 ,故答案为:
,故答案为: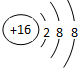 ;
;(2)A的常见单质为氮气,它的电子式为
 ,故答案为:
,故答案为: ;
;(3)D为铝元素,位于第三周期第ⅢA族元素,故答案为:第三周期IIIA族;
(4)B和C简单离子具有相同的电子排布,原子序数大的离子半径小,则离子半径为O2->Na+,故答案为:O2->Na+;
(5)不能利用物理性质(如颜色、状态)来比较非金属性,也不能根据单质在自然界中的存在状态判断非金属性的强弱,可利用氢化物的稳定性或元素在周期表的位置等来比较非金属性,故答案为:ad;
(6)C和E形成的化合物是硫化钠,用电子式表示它的形成过程为
 ,故答案为:
,故答案为: ;
;(7)B和C形成的既含有离子键又含有非极性键的物质是Na2O2,它的电子式为
 ,故答案为:
,故答案为: ;
;(8)E的最高价氧化物的水化物是硫酸,D的最高价氧化物的水化物是氢氧化铝,它们反应的离子方程式为Al(OH)3+3H+=Al3++3H2O,故答案为:Al(OH)3+3H+=Al3++3H2O;
点评:本题考查位置、结构、性质的关系及应用,明确元素的性质推断出各元素是解答本题的关键,解题时注意化学用语的规范表达,及元素及其化合物的性质的灵活运用,题目难度不大.

练习册系列答案
 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案
相关题目
实验室要用98%的浓硫酸(密度为1.84g?ml-1)配制0.5mol?L-1硫酸溶液480ml,选用的主要仪器有烧杯、胶头滴管、玻璃棒、量筒,还缺少( )
| A、容量瓶 |
| B、250ml容量瓶 |
| C、分液漏斗 |
| D、500ml容量瓶 |
 某反应的过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能).下列有关叙述正确的是( )
某反应的过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能).下列有关叙述正确的是( )| A、该反应为放热反应 |
| B、催化剂能改变反应的焓变 |
| C、催化剂能降低反应的活化能E1和 E2 |
| D、增大反应物的浓度,可使单位体积内活化分子百分数增大,反应速率加快 |
25℃时,10mL 0.1mol.L-1NH4Cl溶液中存在平衡:NH4++H2O?NH3?H2O+H+.对于该平衡,下列叙述正确的是( )
| A、加入大量水稀释时,平衡向右移动,溶液中c(H+)减小 |
| B、加入几滴浓盐酸,平衡向左移动,溶液的pH值增大 |
| C、加入几滴浓氨水,平衡向逆反应方向移动,c(OH-)减小 |
| D、升温至35℃,平衡向右移动,NH4Cl的水解程度减小 |
工业炼铁用到的原料有铁矿石、焦炭、空气、石灰石等,下列对原料在冶炼过程中的作用叙述不正确的是( )
| A、焦炭是铁矿石炼铁时的还原剂 |
| B、焦炭先与空气中的氧气反应,为炼铁提供能量 |
| C、石灰石是助矿石中杂质形成炉渣 |
| D、固体原料需粉碎,增大与气体的接触面 |
下列溶液中氯离子浓度最小的是( )
| A、200 mL 1 mol?L-1NaCl溶液 |
| B、50 mL 0.5 mol?L-1AlCl3溶液 |
| C、100 mL 0.8 mol?L-1MgCl2溶液 |
| D、200 mL 2 mol?L-1KCl溶液 |
下列物质中有自由移动的氯离子的是( )
| A、氯化钠晶体 |
| B、熔化的氯化钾 |
| C、氯酸钾溶液 |
| D、液态氯化氢 |
氮化铝具有耐高温、抗冲击、导热性好等优良性质,广泛应用于电子工业、陶瓷工业等领域.在一定条件下,氮化铝可通过如下反应合成:Al2O3+N2+3C═2AlN+3CO,下列说法正确的是( )
| A、该反应为不属于氧化还原反应 |
| B、Al2O3是氧化剂 |
| C、每生成2mol AlN转移6 mol电子 |
| D、C发生还原反应 |
下列说法正确的是( )
| A、红磷转化为白磷是化学变化 |
| B、原子是不能再分的最小微粒 |
| C、O3是由3个氧原子构成的化合物 |
| D、冰水混合物属于混合物 |