题目内容
6.如图用石墨电极电解CuCl2溶液.下列分析不正确的是( )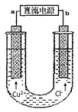
| A. | a端是直流电源的负极 | |
| B. | 通电使CuCl2发生电离 | |
| C. | 阴极上发生的反应:Cu2++2e-=Cu | |
| D. | 通电后,在阳极附近可观察到黄绿色气体 |
分析 由图可知,有外加电源,为电解装置,阳离子向阴极移动,可知a为电源负极,b为正极,阳极上阴离子放电,以此来解答.
解答 解:A.阳离子向阴极移动,可知a为电源负极,故A正确;
B.通电使离子作定向移动,溶于水为电离的条件,故B错误;
C.阴极上发生还原反应,电极反应为Cu2++2e-=Cu,故C正确;
D.阳极上发生2Cl--2e-=Cl2↑,则阳极附近可观察到黄绿色气体,故D正确;
故选B.
点评 本题考查电解原理,为高频考点,把握电化学装置、离子移动方向、电极反应为解答的关键,侧重分析与应用能力的考查,注意电离与通电的区别,题目难度不大.

练习册系列答案
相关题目
16.运用化学反应原理研究NH3的性质具有重要意义.请回答下列问题:
(1)氨气可以构成燃料电池,其电池反应原理为4NH3+3O2=2N2+6H2O.NH3应通入燃料电池的负极(填“正极”或“负极”).已知电解质溶液为KOH溶液,负极的电极反应式为2NH3+6OH--6e-═N2+6H2O.
(2)在0.5L恒容密闭容器中,一定量的N2与H2进行反应:N2(g)+3H2(g)?2NH3(g)△H=bkJ•mol-1,其化学平衡常数K与温度的关系如表:
①写出该反应的化学平衡常数的表达式:K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})•{c}^{3}({H}_{2})}$,b小于0(填“大于”“小于”或“等于”).
②理论上,为了增大平衡时H2的转化率,可采取的措施是ad(填字母序号);
a.增大压强 b.使用合适的催化剂
c.升高温度 d.及时分离出产物中的NH3
③400℃时,测得某时刻氨气、氮气、氢气的物质的量分别为3mol、2mol、1mol时,此时刻该反应的v正(N2) 小于v逆(N2)(填“大于”“小于”或“等于”).
(3)已知:
①4NH3(g)+3O2(g)═2N2(g)+6H2O(g)△H=-1266.8kJ•mol-1
②N2(g)+O2(g)═2NO(g)△H=+180.5kJ•mol-1
写出氨高温催化氧化的热化学方程式4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H=-905.8 kJ/mol.
(1)氨气可以构成燃料电池,其电池反应原理为4NH3+3O2=2N2+6H2O.NH3应通入燃料电池的负极(填“正极”或“负极”).已知电解质溶液为KOH溶液,负极的电极反应式为2NH3+6OH--6e-═N2+6H2O.
(2)在0.5L恒容密闭容器中,一定量的N2与H2进行反应:N2(g)+3H2(g)?2NH3(g)△H=bkJ•mol-1,其化学平衡常数K与温度的关系如表:
| 温度/℃ | 200 | 300 | 400 |
| K | 1.0 | 0.85 | 0.5 |
②理论上,为了增大平衡时H2的转化率,可采取的措施是ad(填字母序号);
a.增大压强 b.使用合适的催化剂
c.升高温度 d.及时分离出产物中的NH3
③400℃时,测得某时刻氨气、氮气、氢气的物质的量分别为3mol、2mol、1mol时,此时刻该反应的v正(N2) 小于v逆(N2)(填“大于”“小于”或“等于”).
(3)已知:
①4NH3(g)+3O2(g)═2N2(g)+6H2O(g)△H=-1266.8kJ•mol-1
②N2(g)+O2(g)═2NO(g)△H=+180.5kJ•mol-1
写出氨高温催化氧化的热化学方程式4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H=-905.8 kJ/mol.
17.几种短周期元素的原子半径及主要化合价如表:则下列相关叙述正确的是( )
| 元素代号 | L | M | X | R | T | Q |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 | 0.078 |
| 主要化合价 | +2 | +3 | +6、-2 | +2 | -2 | +5、-3 |
| A. | 简单氢化物的沸点:X>T>Q | |
| B. | 离子半径:X2->T2->L2+>M3+ | |
| C. | 工业上用电解熔融状态的L和T的化合物制取单质L | |
| D. | L、M的最高价氧化物对应的水化物既能与强碱反应又能与强酸反应 |
14.煤、石油、天然气是人类使用的主要能源,下列说法正确的是( )
| A. | 煤、石油、天然气均为混合物,煤中含有苯等有机物 | |
| B. | 石油裂化和煤的干馏都是化学变化,而石油的分馏和煤的气化都是物理变化 | |
| C. | 石油的裂解主要目的是提高汽油的产量和质量 | |
| D. | 汽油燃烧产生的汽车尾气中,所含的大气污染物主要是碳氮的氧化物 |
1.下列关于铜的说法不正确的是( )
| A. | 铜长期放置在潮湿的空气中容易生锈,生成Cu(OH)2 | |
| B. | 铜丝在氯气中燃烧生成CuCl2而与硫反应生成Cu2S,说明氧化性Cl2>S | |
| C. | CuO不及Cu2O稳定,高温条件下CuO可以分解生成Cu2O和氧气 | |
| D. | 蓝色的CuSO4•5H2O可以受热分解转化为白色的CuSO4 |
11.某化学小组对Na2SO3和AgNO3在不同pH下的反应及产物,进行了以下实验探究.
查阅资料:Ⅰ.Ag2SO3:白色、难溶于水;
Ⅱ.Ag2O:棕黑色、难溶于水,易与酸溶液反应.
(1)根据资料:
①通常情况Na2SO3溶液和AgNO3溶液反应产生的现象是产生白色浑浊.
②若Ag2O与盐酸反应,其化学方程式应为Ag2O+2HCl=2AgCl+H2O.
(2)检测溶液pH:
①0.1mol/LAgNO3溶液的pH=5,引发这一结果的微粒是Ag+.
②0.1mol/LNa2SO3溶液的pH=10,其原因用离子方程式解释是SO32-+H2O=HSO3-+OH-.
(3)实验探究:在不同pH条件下Na2SO3溶液与AgNO3溶液混合反应.实验记录如图:
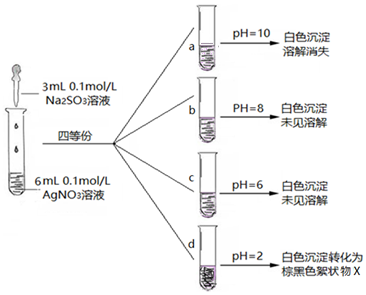
Ⅰ.实验a中沉淀溶解消失的原因,可能是Ag2SO3在碱性较强条件下,溶解或Ag2SO3被氧化成Ag2SO4溶解.
Ⅱ.Ag2SO3在溶液中沉淀析出的大致pH范围是6-8.
Ⅲ.将d中棕黑色絮状物X滤出、洗净、进行实验分析:
①由实验ⅰ得出的结论是黑棕色沉淀不是Ag2O.
②d中的棕黑色絮状物X是Ag.
③实验ⅱ中的化学反应方程式是Ag+2HNO3(浓)=AgNO3+NO2↑+H2O.
(4)小组认为在酸性条件下,SO32-的还原性增强,生成X的化学方程式是Ag2SO3+H2O=2Ag+H2SO4.
查阅资料:Ⅰ.Ag2SO3:白色、难溶于水;
Ⅱ.Ag2O:棕黑色、难溶于水,易与酸溶液反应.
(1)根据资料:
①通常情况Na2SO3溶液和AgNO3溶液反应产生的现象是产生白色浑浊.
②若Ag2O与盐酸反应,其化学方程式应为Ag2O+2HCl=2AgCl+H2O.
(2)检测溶液pH:
①0.1mol/LAgNO3溶液的pH=5,引发这一结果的微粒是Ag+.
②0.1mol/LNa2SO3溶液的pH=10,其原因用离子方程式解释是SO32-+H2O=HSO3-+OH-.
(3)实验探究:在不同pH条件下Na2SO3溶液与AgNO3溶液混合反应.实验记录如图:

Ⅰ.实验a中沉淀溶解消失的原因,可能是Ag2SO3在碱性较强条件下,溶解或Ag2SO3被氧化成Ag2SO4溶解.
Ⅱ.Ag2SO3在溶液中沉淀析出的大致pH范围是6-8.
Ⅲ.将d中棕黑色絮状物X滤出、洗净、进行实验分析:
| 实验 | 操作 | 现象 |
| ⅰ | 将其置于试管中加稀盐酸、观察 | 无明显现象 |
| ⅱ | 将其置于试管中加足量浓硝酸、观察 | 立即产生红棕色气体 |
| ⅲ | 在ⅱ反应所得溶液中,加Ba(NO3)2溶液、观察,再加BaCl2、观察 | 前者无明显现象,后者出现白色沉淀 |
②d中的棕黑色絮状物X是Ag.
③实验ⅱ中的化学反应方程式是Ag+2HNO3(浓)=AgNO3+NO2↑+H2O.
(4)小组认为在酸性条件下,SO32-的还原性增强,生成X的化学方程式是Ag2SO3+H2O=2Ag+H2SO4.
18.有四种常见短周期主族元素R、X、Y、Z,下表列出了它们的部分性质.其中下列说法不正确的是( )
| R | 原子最外层电子数是电子总数的$\frac{2}{3}$ |
| X | 单质不能将比它不活泼的金属从其盐溶液中置换出来 |
| Y | 第三周期原子半径最小的金属 |
| Z | 单质是淡黄色固体 |
| A. | R的最高价氧化物既能与某种非金属单质反应,又能与某种金属单质反应 | |
| B. | X、Y、Z的氧化物分别投入NaOH溶液中一定都能发生反应 | |
| C. | X、Y、Z的原子半径依次减小,离子半径依次增大 | |
| D. | X、Y、Z的最高价氧化物对应水化物之间可以两两反应 |
9.下列是一些装置气密性检查的方法,其中正确的是( )
| A. |  | B. |  | C. |  | D. |  |