题目内容
5.单质及其化合物在一定条件下可发生如图所示的变化,五种物质中都含有同一种元素,其中a在常温下是一种气体,在空气中的含量为78%.根据已知信息完成下面内容: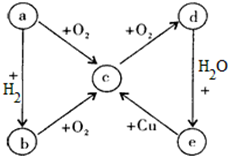
(1)b的化学式是NH3,c的化学式是NO,e的化学式是HNO3.
(2)a→b的化学方程式N2+O2$\frac{\underline{\;放电\;}}{\;}$2NO,d→e的化学方程式3NO2+H2O=2HNO3+NO.
分析 a、b、c、d、e五种物质中都含有一种相同的元素,其中a在常温下是一种气体,在空气中的含量为78%,则a为N2,根据框图转化关系,a与氢气反应生成b为NH3,氨气氧化生成c为NO,NO氧化生成d为NO2,二氧化氮与水反应生成e为HNO3,铜与稀硝酸反应生成NO,符合各物质转化关系,以此解答该题.
解答 解:a、b、c、d、e五种物质中都含有一种相同的元素,其中a在常温下是一种气体,在空气中的含量为78%,则a为N2,根据框图转化关系,a与氢气反应生成b为NH3,氨气氧化生成c为NO,NO氧化生成d为NO2,二氧化氮与水反应生成e为HNO3,铜与稀硝酸反应生成NO,符合各物质转化关系,
(1)由上述分析可知,b为NH3,c为NO,e为HNO3,
故答案为:NH3;NO;HNO3;
(2)a→b的化学方程式为N2+O2$\frac{\underline{\;放电\;}}{\;}$2NO,d→e的化学方程式为3NO2+H2O=2HNO3+NO,
故答案为:N2+O2$\frac{\underline{\;放电\;}}{\;}$2NO;3NO2+H2O=2HNO3+NO.
点评 本题考查无机物推断,涉及N元素单质化合物的性质,侧重对基础知识的巩固,难度不大.

练习册系列答案
 导学教程高中新课标系列答案
导学教程高中新课标系列答案 小学课时特训系列答案
小学课时特训系列答案
相关题目
15.酸性KMnO4溶液与草酸溶液(H2C2O4)溶液反应.现用浓度为0.01mol/L酸性KMnO4溶液滴定未知浓度的草酸,请回答下列问题:
(1)写出滴定过程中发生反应的离子方程式:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O
(2)配制标准溶液500.00ml,配制过程需用的仪器除托盘天平,药匙,烧杯,玻璃棒外还需要500mL容量瓶、胶头滴管
(3)用KMnO4滴定草酸溶液,需要选指示剂吗?如需要则填上指示剂名称,若不需要填上“无”KMnO4溶液,在操作过程中左手旋转滴定管的玻璃活塞,右手振荡锥形瓶,终点时的现象当最后一滴KMnO4溶液滴入时,溶液为紫红色,且半分钟内不褪色
(4)记录数据如下:
则测出的草酸溶液的物质的量浓度为0.25mol•L-1
(5)下列操作会导致测定草酸浓度偏高的是AC
A.滴定前滴定管尖嘴中有气泡,滴定后气泡消失
B.配制标准溶液时俯视刻度线
C.未用标准液润洗滴定管
D.滴定前盛放草酸溶液的锥形瓶用蒸馏水洗净后没有干燥.
(1)写出滴定过程中发生反应的离子方程式:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O
(2)配制标准溶液500.00ml,配制过程需用的仪器除托盘天平,药匙,烧杯,玻璃棒外还需要500mL容量瓶、胶头滴管
(3)用KMnO4滴定草酸溶液,需要选指示剂吗?如需要则填上指示剂名称,若不需要填上“无”KMnO4溶液,在操作过程中左手旋转滴定管的玻璃活塞,右手振荡锥形瓶,终点时的现象当最后一滴KMnO4溶液滴入时,溶液为紫红色,且半分钟内不褪色
(4)记录数据如下:
| 滴定次数 | 待测溶液体积/ml | KMnO4溶液体积/ml | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 1.50 | 23.70 |
| 2 | 25.00 | 1.02 | 26.03 |
| 3 | 25.00 | 0.00 | 24.99 |
(5)下列操作会导致测定草酸浓度偏高的是AC
A.滴定前滴定管尖嘴中有气泡,滴定后气泡消失
B.配制标准溶液时俯视刻度线
C.未用标准液润洗滴定管
D.滴定前盛放草酸溶液的锥形瓶用蒸馏水洗净后没有干燥.
13.按碳骨架分类,下列说法正确的是( )
| A. |  属于醇类化合物 属于醇类化合物 | B. |  属于芳香族化合物 属于芳香族化合物 | ||
| C. | CH 3CH(CH 3 )2 属于链状化合物 | D. |  属于脂环化合物 属于脂环化合物 |
20.SO2溶于水所得溶液的性质为( )
| A. | 有氧化性,无还原性,无酸性 | B. | 无氧化性,有还原性,无酸性 | ||
| C. | 有氧化性,有还原性,有酸性 | D. | 无氧化性,有还原性,有酸性 |
10.Ⅰ.某实验小组对H2O2的分解做了如下探究.下表是该实验小组研究影响H2O2分解速率的因素时记录的一组数据,将质量相同的粉末状和块状的MnO2分别加入盛有15ml 5%的H2O2溶液的大试管中,并用带火星的木条测试,结果如表:
(1)写出上述实验中发生反应的化学方程式:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
(2)实验结果表明,催化剂的催化效果与催化剂的表面积有关.
(3)某同学在10mL H2O2 溶液中加入一定量的二氧化锰,放出气体的体积(标准状况)与反应时间的关系如图1所示,则A、B、C三点所表示的反应速率最慢的是C.
Ⅱ.某反应在体积为5L的恒容密闭容器中进行,在0-3分钟内各物质的量的变化情况如图2所示(A,B,C均为气体,且A气体有颜色).
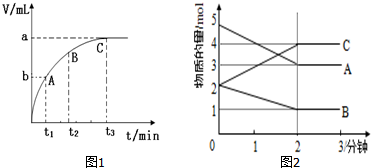
(4)该反应的化学方程式为2A+B?2C.
(5)反应开始至2分钟时,B的平均反应速率为0.1mol/(L•min).
(6)能说明该反应已达到平衡状态的是cd.
a.v(A)=2v(B)
b.容器内各物质的物质的量相等
c.v逆(A)=v正(C)
d.容器内气体的颜色保持不变
(7)由图求得平衡时A的体积分数37.5%.
| MnO2 | 触摸试管情况 | 观察结果 | 反应完成所需的时间 |
| 粉末状 | 很烫 | 剧烈反应,带火星的木条复燃 | 3.5min |
| 块状 | 微热 | 反应较慢,火星红亮但木条未复燃 | 30min |
(2)实验结果表明,催化剂的催化效果与催化剂的表面积有关.
(3)某同学在10mL H2O2 溶液中加入一定量的二氧化锰,放出气体的体积(标准状况)与反应时间的关系如图1所示,则A、B、C三点所表示的反应速率最慢的是C.
Ⅱ.某反应在体积为5L的恒容密闭容器中进行,在0-3分钟内各物质的量的变化情况如图2所示(A,B,C均为气体,且A气体有颜色).

(4)该反应的化学方程式为2A+B?2C.
(5)反应开始至2分钟时,B的平均反应速率为0.1mol/(L•min).
(6)能说明该反应已达到平衡状态的是cd.
a.v(A)=2v(B)
b.容器内各物质的物质的量相等
c.v逆(A)=v正(C)
d.容器内气体的颜色保持不变
(7)由图求得平衡时A的体积分数37.5%.
14.下列叙述正确的是( )
| A. | 物质燃烧不一定是放热反应 | |
| B. | 放热反应一定不需要从外界吸收任何能量就能发生 | |
| C. | 化学反应除了生成新的物质外,还伴随着能量的变化 | |
| D. | 在一个确定的化学反应中,反应物总能量总是高于生成物总能量 |
15.下列关于实验室制备或操作不需要使用温度计的是( )
| A. | 制取银镜 | B. | 工业乙醇的蒸馏 | C. | 制硝基苯 | D. | 制乙烯 |
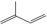 ,A与Br2按物质的量比l:l 发生加成反应,请写出生成的所有产物的结构简式为CH2BrCBr(CH3)CH=CH2、CH2=C(CH3)CHBrCH2Br、CH2BrC(CH3)=CHCH2Br(不考虑顺反异构).
,A与Br2按物质的量比l:l 发生加成反应,请写出生成的所有产物的结构简式为CH2BrCBr(CH3)CH=CH2、CH2=C(CH3)CHBrCH2Br、CH2BrC(CH3)=CHCH2Br(不考虑顺反异构). .
.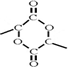 含有三元环:
含有三元环: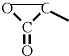 .
.