题目内容
15.下列关于实验室制备或操作不需要使用温度计的是( )| A. | 制取银镜 | B. | 工业乙醇的蒸馏 | C. | 制硝基苯 | D. | 制乙烯 |
分析 A.银镜反应不需要温度计,用水浴加热的方法;
B.工业乙醇的蒸馏:当温度是77℃以下蒸出的是甲醇,77℃到79℃蒸出的是乙醇,79℃以上水和乙醇,需要温度计测量蒸气的温度;
C.苯、浓硫酸、浓硝酸在50-60℃的水浴中反应生成硝基苯,需要温度计测量水浴的温度;
D.乙醇和浓硫酸在170℃的条件下发生消去反应生成乙烯,需要温度计测量反应液的温度.
解答 解:A.银镜反应不需要温度计,用水浴加热的方法,故A正确;
B.工业乙醇的蒸馏:当温度是77℃以下蒸出的是甲醇,77℃到79℃蒸出的是乙醇,79℃以上水和乙醇,需要温度计测量蒸气的温度,故B错误;
C.苯、浓硫酸、浓硝酸在50-60℃的水浴中反应生成硝基苯,需要温度计测量水浴的温度,故C错误;
D.乙醇和浓硫酸在170℃的条件下发生消去反应生成乙烯,需要温度计测量反应液的温度,故D错误;
故选A.
点评 本题主要考查了温度计的使用,掌握实验室制取乙烯、硝基苯、银镜反应以及工业乙醇的蒸馏的实验条件是解答的关键,题目难度不大.

练习册系列答案
相关题目
3.某烃结构简式为CH 3-CH 2-CH=C (C 2H 5)-C≡CH分子中含有四面体结构的碳原子数为a,在同一直线上的碳原子数量最多为b,一定在同一平面内的碳原子数为c,则a、b、c分别为( )
| A. | 4、3、5 | B. | 4、3、6 | C. | 2、5、4 | D. | 4、4、6 |
20.下列说法正确的是( )
| A. | 乳酸薄荷醇酯(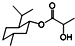 )不仅能发生氧化、消去反应,还能发生取代反应 )不仅能发生氧化、消去反应,还能发生取代反应 | |
| B. | 乙醛和丙烯醛( )不是同系物,它们与氢气充分反应后的产物也不是同系物 )不是同系物,它们与氢气充分反应后的产物也不是同系物 | |
| C. | 按系统命名法,化合物 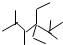 的名称是2,3,5,5-四甲基-4,4-二乙基己烷 的名称是2,3,5,5-四甲基-4,4-二乙基己烷 | |
| D. | 化合物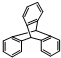 是苯的同系物 是苯的同系物 |
7.关于如图各装置的叙述中,正确的是( )


| A. | 装置①可用于分离I2与NH4Cl混合物 | |
| B. | 装置②收集并测量Cu与浓硫酸反应产生的气体的体积 | |
| C. | 装置③制取氯气 | |
| D. | 装置④制取无水MgCl2 |
4.研究汽车尾气中含氮污染物的治理是环保的一项重要工作.
(1)NH3催化还原NxOy可以消除氮氧化物的污染,包含以下反应:
反应Ⅰ:4NH3(g)+6NO(g)?5N2(g)+6H2O(l)△H1
反应Ⅱ:2NO(g)+O2(g)?2NO2(g)△H2
反应Ⅲ:4NH3(g)+6NO2(g)?5N2(g)+3O2(g)+6H2O(l)△H3
则△H3=△H1-3△H2(用△H1和△H2的代数式表示).n(N2)(mol)
相同条件下,反应I在2L密闭容器内,选用不同的催化剂,反应产生N2的量随时间变化如图1所示.
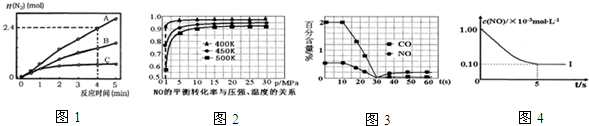
①计算0~4min在A催化剂作用下,反应速率v(NO)=0.36mol•L-1•min-1.
②下列说法不正确的是a.
a.该反应的活化能大小顺序是:Ea(A)>Eb(B)>Ec(C)
b.缩小体积能使体系压强增大,反应速率加快,但活化分子的百分数不变
c.单位时间内H-O键与N-H键断裂的数目相等时,说明反应已经达到平衡
d.若在恒容绝热的密闭容器中发生反应,当K值不变时,说明反应已经达到平衡
(2)三元催化转化装置是安装在汽车排气系统中最重要的机外净化装置,装置中涉及的反应之一为:2NO(g)+2CO(g)?N2(g)+2CO2(g).
①探究上述反应中NO的平衡转化率与压强、温度的关系,得到如图2所示的曲线.催化装置比较适合的温度和压强是400K,1MPa.
②测试某型号汽车在冷启动(冷启动指发动机水温低的情况下启动)时催化装置内CO和NO百分含量随时间变化曲线如图3所示.则前10s内,CO和NO百分含量没明显变化的原因是尚未达到催化剂工作温度(或尚未达到反应的温度).
③研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率.为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了如表三组实验:
根据坐标图4,计算400K时该反应的平衡常数为5000L•mol-1;并在图中画出上表中的实验II、III条件下混合气体中NO浓度随时间变化的趋势曲线图(标明各条曲线的实验编号).
(1)NH3催化还原NxOy可以消除氮氧化物的污染,包含以下反应:
反应Ⅰ:4NH3(g)+6NO(g)?5N2(g)+6H2O(l)△H1
反应Ⅱ:2NO(g)+O2(g)?2NO2(g)△H2
反应Ⅲ:4NH3(g)+6NO2(g)?5N2(g)+3O2(g)+6H2O(l)△H3
则△H3=△H1-3△H2(用△H1和△H2的代数式表示).n(N2)(mol)
相同条件下,反应I在2L密闭容器内,选用不同的催化剂,反应产生N2的量随时间变化如图1所示.

①计算0~4min在A催化剂作用下,反应速率v(NO)=0.36mol•L-1•min-1.
②下列说法不正确的是a.
a.该反应的活化能大小顺序是:Ea(A)>Eb(B)>Ec(C)
b.缩小体积能使体系压强增大,反应速率加快,但活化分子的百分数不变
c.单位时间内H-O键与N-H键断裂的数目相等时,说明反应已经达到平衡
d.若在恒容绝热的密闭容器中发生反应,当K值不变时,说明反应已经达到平衡
(2)三元催化转化装置是安装在汽车排气系统中最重要的机外净化装置,装置中涉及的反应之一为:2NO(g)+2CO(g)?N2(g)+2CO2(g).
①探究上述反应中NO的平衡转化率与压强、温度的关系,得到如图2所示的曲线.催化装置比较适合的温度和压强是400K,1MPa.
②测试某型号汽车在冷启动(冷启动指发动机水温低的情况下启动)时催化装置内CO和NO百分含量随时间变化曲线如图3所示.则前10s内,CO和NO百分含量没明显变化的原因是尚未达到催化剂工作温度(或尚未达到反应的温度).
| 实验编号 | T(K) | NO初始浓度 (mol•L-1) | CO初始浓度 (mol•L-1) | 催化剂的比表面积(m2/g) |
| Ⅰ | 400 | 1.00×10-3 | 3.60×10-3 | 82 |
| Ⅱ | 400 | 1.00×10-3 | 3.60×10-3 | 124 |
| Ⅲ | 450 | 1.00×10-3 | 3.60×10-3 | 124 |
根据坐标图4,计算400K时该反应的平衡常数为5000L•mol-1;并在图中画出上表中的实验II、III条件下混合气体中NO浓度随时间变化的趋势曲线图(标明各条曲线的实验编号).
5.下列有关实验的操作、现象及结论解析都没有科学性错误的是( )
| 选项 | 实验操作 | 现象 | 结论 |
| A | 将光亮的镁条放入盛有NH4Cl溶液的试管中 | 有大量气泡产生 | 生成的气体是NH3 |
| B | 向AgI悬浊液中加入NaCl细粒 | 一定不出现白色沉淀 | 更难溶的物质无法转化为难溶的物质 |
| C | 某实验小组从资料上获得信息:Fe3+可以氧化银单质.他们用这种方法清洗了一批做了银镜反应的试管.配制了Fe3+浓度相同的FeCl3溶液和Fe2(SO4)3溶液,分别用于清洗试管. | 用FeCl3溶液清洗比用Fe2(SO4)3溶液清洗得干净 | Fe3+氧化银单质的过程可能是一个可逆过程: Fe3++Ag?Fe2++Ag+ |
| D | 向某溶液中滴加氯水后再加入KSCN溶液 | 溶液呈红色 | 溶液中一定含有Fe2+ |
| A. | A | B. | B | C. | C | D. | D |
 化学对人类社会进步和发展的贡献之一是发现和研制了各种材料,例如,金属就是我们生活中不可或缺的重要材料,根据你学过的有关金属的知识,回答下列问题:
化学对人类社会进步和发展的贡献之一是发现和研制了各种材料,例如,金属就是我们生活中不可或缺的重要材料,根据你学过的有关金属的知识,回答下列问题: