题目内容
14.下列叙述正确的是( )| A. | 物质燃烧不一定是放热反应 | |
| B. | 放热反应一定不需要从外界吸收任何能量就能发生 | |
| C. | 化学反应除了生成新的物质外,还伴随着能量的变化 | |
| D. | 在一个确定的化学反应中,反应物总能量总是高于生成物总能量 |
分析 A.物质的燃烧反应都是放热反应;
B.某些物质的燃烧,需要吸收能量,达到着火点;
C.化学反应中除了遵循质量守恒定律,还遵循能量守恒定律;
D.根据△H=生成物的能量和-反应物的能量和来判断.
解答 解:A.所有物质的燃烧反应都是放热反应,故A错误;
B.某些物质的燃烧,需要从外界吸收能量,达到着火点,故B错误;
C.化学反应中除了遵循质量守恒定律,还遵循能量守恒定律,故C正确;
D.根据△H=生成物的能量和-反应物的能量和,在确定的化学反应中,反应物的总能量可能高于生成物的总能量,也可能低于生成物的总能量,故D错误;
故选C.
点评 本题考查了反应热的判断与以及反应的吸放热和反应条件之间的关系,题目难度不大,注意知识的归纳和梳理是关键.

练习册系列答案
相关题目
4.X、Y、Z为短周期元素,X原子的最外层只有一个电子,Y原子的最外层电子数比内层电子总数少4,Z原子的最外层电子数是内层电子数的三倍.下列有关叙述正确的是( )
| A. | X、Y、Z三种元素可形成化合物X3YZ4 | |
| B. | X、Y两元素形成的化合物只能为离子化合物 | |
| C. | 氢化物的熔沸点:Y<Z | |
| D. | 氢化物的稳定性:Y>Z |
2.研究有机物一般经过以下几个基本步骤:分离、提纯→确定实验式→确定分子式→确定结构式.有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取.纯净的A为无色粘稠液体,易溶于水.为研究A的组成与结构,进行了如下实验:
| 实 验 步 骤 | 解 释 或 实 验 结 论 |
| (1)称取A 9.0g,升温使其汽化,测其密度是相同条件下H2的45倍. | 试通过计算填空: (1)A的相对分子质量为90. |
| (2)将此9.0gA在足量纯O2充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重 5.4g和13.2g. | (2)A的分子式为C3H6O3. |
| (3)另取A 9.0g,跟足量的NaHCO3粉末反应,生成2.24LCO2(标准状况),若与足量金属钠反应则生成2.24LH2(标准状况). | (3)用结构简式表示A中含有的官能团 -COOH、-OH |
(4)A的核磁共振氢谱如下图: | (4)A中含有4种氢原子. 综上所述, A的结构简式为  . . |
| (5)两分子A可反应生成一个六元环状化合物 | (5)写出此反应的方程式 2  $→_{△}^{浓硫酸}$ $→_{△}^{浓硫酸}$ +2H2O +2H2O |
9.硫酸亚铁煅烧反应为2FeSO4(s)$\frac{\underline{\;高温\;}}{\;}$X(g)+Fe2O3(s)+SO3(g),有关说法正确的是( )
| A. | 该反应中X为还原产物 | |
| B. | X能使溴水褪色,说明X具有漂白性 | |
| C. | 该反应中每生成1molFe2O3转移电子数约为6.02×1023 | |
| D. | 该反应生成的气体通入足量Ba(NO3)2溶液中,可得到两种沉淀 |
3.某烃结构简式为CH 3-CH 2-CH=C (C 2H 5)-C≡CH分子中含有四面体结构的碳原子数为a,在同一直线上的碳原子数量最多为b,一定在同一平面内的碳原子数为c,则a、b、c分别为( )
| A. | 4、3、5 | B. | 4、3、6 | C. | 2、5、4 | D. | 4、4、6 |
4.研究汽车尾气中含氮污染物的治理是环保的一项重要工作.
(1)NH3催化还原NxOy可以消除氮氧化物的污染,包含以下反应:
反应Ⅰ:4NH3(g)+6NO(g)?5N2(g)+6H2O(l)△H1
反应Ⅱ:2NO(g)+O2(g)?2NO2(g)△H2
反应Ⅲ:4NH3(g)+6NO2(g)?5N2(g)+3O2(g)+6H2O(l)△H3
则△H3=△H1-3△H2(用△H1和△H2的代数式表示).n(N2)(mol)
相同条件下,反应I在2L密闭容器内,选用不同的催化剂,反应产生N2的量随时间变化如图1所示.
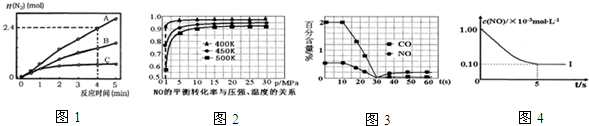
①计算0~4min在A催化剂作用下,反应速率v(NO)=0.36mol•L-1•min-1.
②下列说法不正确的是a.
a.该反应的活化能大小顺序是:Ea(A)>Eb(B)>Ec(C)
b.缩小体积能使体系压强增大,反应速率加快,但活化分子的百分数不变
c.单位时间内H-O键与N-H键断裂的数目相等时,说明反应已经达到平衡
d.若在恒容绝热的密闭容器中发生反应,当K值不变时,说明反应已经达到平衡
(2)三元催化转化装置是安装在汽车排气系统中最重要的机外净化装置,装置中涉及的反应之一为:2NO(g)+2CO(g)?N2(g)+2CO2(g).
①探究上述反应中NO的平衡转化率与压强、温度的关系,得到如图2所示的曲线.催化装置比较适合的温度和压强是400K,1MPa.
②测试某型号汽车在冷启动(冷启动指发动机水温低的情况下启动)时催化装置内CO和NO百分含量随时间变化曲线如图3所示.则前10s内,CO和NO百分含量没明显变化的原因是尚未达到催化剂工作温度(或尚未达到反应的温度).
③研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率.为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了如表三组实验:
根据坐标图4,计算400K时该反应的平衡常数为5000L•mol-1;并在图中画出上表中的实验II、III条件下混合气体中NO浓度随时间变化的趋势曲线图(标明各条曲线的实验编号).
(1)NH3催化还原NxOy可以消除氮氧化物的污染,包含以下反应:
反应Ⅰ:4NH3(g)+6NO(g)?5N2(g)+6H2O(l)△H1
反应Ⅱ:2NO(g)+O2(g)?2NO2(g)△H2
反应Ⅲ:4NH3(g)+6NO2(g)?5N2(g)+3O2(g)+6H2O(l)△H3
则△H3=△H1-3△H2(用△H1和△H2的代数式表示).n(N2)(mol)
相同条件下,反应I在2L密闭容器内,选用不同的催化剂,反应产生N2的量随时间变化如图1所示.

①计算0~4min在A催化剂作用下,反应速率v(NO)=0.36mol•L-1•min-1.
②下列说法不正确的是a.
a.该反应的活化能大小顺序是:Ea(A)>Eb(B)>Ec(C)
b.缩小体积能使体系压强增大,反应速率加快,但活化分子的百分数不变
c.单位时间内H-O键与N-H键断裂的数目相等时,说明反应已经达到平衡
d.若在恒容绝热的密闭容器中发生反应,当K值不变时,说明反应已经达到平衡
(2)三元催化转化装置是安装在汽车排气系统中最重要的机外净化装置,装置中涉及的反应之一为:2NO(g)+2CO(g)?N2(g)+2CO2(g).
①探究上述反应中NO的平衡转化率与压强、温度的关系,得到如图2所示的曲线.催化装置比较适合的温度和压强是400K,1MPa.
②测试某型号汽车在冷启动(冷启动指发动机水温低的情况下启动)时催化装置内CO和NO百分含量随时间变化曲线如图3所示.则前10s内,CO和NO百分含量没明显变化的原因是尚未达到催化剂工作温度(或尚未达到反应的温度).
| 实验编号 | T(K) | NO初始浓度 (mol•L-1) | CO初始浓度 (mol•L-1) | 催化剂的比表面积(m2/g) |
| Ⅰ | 400 | 1.00×10-3 | 3.60×10-3 | 82 |
| Ⅱ | 400 | 1.00×10-3 | 3.60×10-3 | 124 |
| Ⅲ | 450 | 1.00×10-3 | 3.60×10-3 | 124 |
根据坐标图4,计算400K时该反应的平衡常数为5000L•mol-1;并在图中画出上表中的实验II、III条件下混合气体中NO浓度随时间变化的趋势曲线图(标明各条曲线的实验编号).
