题目内容
1.下列各项所述的数字不是6的是( )| A. | 在NaCl晶体中,与一个Na+最近的且距离相等的Cl-的个数 | |
| B. | 在金刚石晶体中,围成最小环的原子数 | |
| C. | 在二氧化硅晶体中,围成最小环的硅原子数 | |
| D. | 在CsCl晶体中,与一个Cs+最近的且距离相等的Cl-的个数 |
分析 A.在NaCl晶体中,一个Na+周围有6个Cl-,一个Cl-周围有6个Na+;
B.金刚石晶体中,最小的环上有6个碳原子;
C.二氧化硅晶体相当于在硅晶体中两个硅原子间分别加上一个O原子,因此最小环上的原子个数为12个,每个最小环上有6个硅原子;
D.根据CsCl晶体的晶胞分析,CsCl中离子的配位数是8.
解答 解:A.NaCl晶体属面心立方结构,晶胞结构如图 ,由结构图可知,氯化钠晶体中钠离子位于顶点和面心,距离顶点最近的氯离子位于棱心,共有6个,氯离子位于棱和体心,距离体心距离最近的钠离子,位于面心,共有6个,则氯离子和钠离子配位数都是6,所以在NaCl晶体中每个Na+(或C1-)周围都紧邻6个Cl-(或Na+),故A正确;
,由结构图可知,氯化钠晶体中钠离子位于顶点和面心,距离顶点最近的氯离子位于棱心,共有6个,氯离子位于棱和体心,距离体心距离最近的钠离子,位于面心,共有6个,则氯离子和钠离子配位数都是6,所以在NaCl晶体中每个Na+(或C1-)周围都紧邻6个Cl-(或Na+),故A正确;
B.金刚石晶体中,由共价键形成的最小碳环上有6个碳原子,每个碳原子形成四个共价键,从而形成空间网状结构,故B正确;
C.由二氧化硅晶体结构图 可知,晶体中最小环上含有6个硅原子和6个氧原子,故C正确;
可知,晶体中最小环上含有6个硅原子和6个氧原子,故C正确;
D.由氯化铯体的晶胞可知,CsCl晶体中每个Cs+周围紧邻的有8个Cl-,而和每个Cl-等距离紧邻的也有8个Cs+,故D错误;
故选D.
点评 本题考查了晶体的结构分析,重点是对结构图象的观察与理解,掌握常见晶胞的结构是解题的关键,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
9.已知短周期元素的离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,下列关系正确的( )
| A. | 质子数:c>b | B. | 离子的还原性:Y2-<Z- | ||
| C. | 氢化物的稳定性:H2Y>HZ | D. | 粒子半径:cY2->dZ->bX+>aW3+ |
16.下列关于化学键的叙述正确的是( )
| A. | 化学键存在于原子之间,也能存在于分子与离子之间 | |
| B. | 两个原子之间的相互作用叫做化学键 | |
| C. | 离子键是阴、阳离子之间的吸引力 | |
| D. | 化学键通常指的是任意两个或多个原子之间强烈的相互作用 |
6.以下性质的比较中,不正确的是( )
| A. | 晶格能 NaCl<MgO | B. | 热稳定性:HF>H2O>NH3 | ||
| C. | 离子半径:Na+<O2- | D. | 第一电离能:P>Cl>S |
13.2SO2(g)+O2(g)?2SO3(g)(正反应放热).下列有关说法正确的是( )
| A. | 若降低温度,可以加快反应速率 | |
| B. | 使用催化剂是为了加快反应速率 | |
| C. | 在上述条件下,SO2能完全转化为SO3 | |
| D. | 达到平衡时,SO2和SO3的浓度一定相等 |
10.设阿伏加德罗常数为 NA,则下列说法正确的是( )
| A. | 常温常压下,1mol C nH 2n+2中所含有的共价键数目为(3n+1)N A | |
| B. | 14g 乙烯和丙烯的混合物中含有原子的数目为N A | |
| C. | 标准状况下,1 L戊烷充分燃烧后生成的气态产物的分子数为 $\frac{5}{22.4}$NA | |
| D. | 1.5g 甲基(-CH 3)所含有的电子数是 N A |
11.X、Y、Z、M、G五种主族元素分属三个短周期,且原子序数依次增大.X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子.
请回答下列问题:
(1)Y在元素周期表中的位置为第二周期第ⅥA族.
(2)上述元素的最高价氧化物对应的水化物酸性最强的是HClO4(写化学式),非金属气态氢化物还原性最强的是H2S(写化学式).
(3)Y、G的单质或两元素之间形成的化合物可作水消毒剂的有Cl2、O3、ClO2(写出其中两种物质的化学式).
(4)ZX与水反应放出气体的化学方程式为NaH+H2O=NaOH+H2↑.
(5)探究同主族元素性质的一些共同规律,是学习化学的重要方法之一.元素E位于第四周期,与元素Y同主族.在如表中列出对H2EO3各种不同化学性质的推测,举例并写出相应的化学方程式(化学方程式中E用元素符号表示)
(6)由碳元素(C)、Y和M三种元素组成的化合物CYM中,所有原子的最外层都满足8电子结构.写出该化合物的电子式(电子式中Y、M用元素符号表示)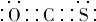 .
.
请回答下列问题:
(1)Y在元素周期表中的位置为第二周期第ⅥA族.
(2)上述元素的最高价氧化物对应的水化物酸性最强的是HClO4(写化学式),非金属气态氢化物还原性最强的是H2S(写化学式).
(3)Y、G的单质或两元素之间形成的化合物可作水消毒剂的有Cl2、O3、ClO2(写出其中两种物质的化学式).
(4)ZX与水反应放出气体的化学方程式为NaH+H2O=NaOH+H2↑.
(5)探究同主族元素性质的一些共同规律,是学习化学的重要方法之一.元素E位于第四周期,与元素Y同主族.在如表中列出对H2EO3各种不同化学性质的推测,举例并写出相应的化学方程式(化学方程式中E用元素符号表示)
| 编号 | 性质推测 | 化学方程式 |
| 示例 | 氧化性 | H2EO3+4HI═Z↓+2I2+3H2O |
| 1 | ||
| 2 |
 .
. 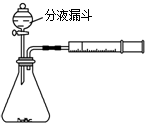 学习了“化学反应的速率是通过实验测得的”以后,某同学设计了下列实验:
学习了“化学反应的速率是通过实验测得的”以后,某同学设计了下列实验: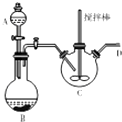 乳酸(
乳酸(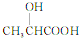 )是一种独特的调味剂,有很强的防腐、保鲜功效.常温下乳酸为无色液体,能与水、乙醇混溶.
)是一种独特的调味剂,有很强的防腐、保鲜功效.常温下乳酸为无色液体,能与水、乙醇混溶.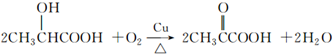 .
.