题目内容
下列分子中键角不是120°的是( )
| A、C2H2 |
| B、C6H6 |
| C、BF3 |
| D、NH3 |
考点:键能、键长、键角及其应用
专题:化学键与晶体结构
分析:利用价层电子对互斥理论判断分子的空间构型,再判断键角,直线形的分子键角为180°,平面正六边形或平面三角形分子的键角为120°,三角锥形分子的键角为107°,据此分析.
解答:
解:A、C2H2中C原子的价层电子对数为2,没有孤电子对,属于sp杂化,分子的空间结构为直线形,键角为180°,故A选;
B、C6H6的空间构型为平面正六边形,键角为120°,故B不选;
C、BF3中B原子价层电子对个数=3+
×(3-3×1)=0,B原子价层电子对个数为3且不含孤电子对,中心原子B是SP2杂化,所以为平面正三角形结构,键角为120°,故C不选;
D、NH3中N原子价层电子对个数=3+
×(5-3×1)=1,B原子价层电子对个数为3且含1个孤电子对,中心原子C是SP3杂化,所以为三角锥形结构,键角为107°,故D选;
故选AD.
B、C6H6的空间构型为平面正六边形,键角为120°,故B不选;
C、BF3中B原子价层电子对个数=3+
| 1 |
| 2 |
D、NH3中N原子价层电子对个数=3+
| 1 |
| 2 |
故选AD.
点评:本题考查了分子的空间构型和键角的判断,注意根据价层电子对互斥理论判断分子的空间构型,根据空间构型判断键角,题目难度中等.

练习册系列答案
相关题目
X、Y为短周期元素,X原子各电子层的电子数之比为1:4:1,它比Y原子多3个电子.下列叙述不正确的是( )
| A、X离子的半径小于Y离子的半径 |
| B、X单质在空气中燃烧不止生成一种物质 |
| C、X、Y形成的化合物为共价化合物 |
| D、Y单质极容易与氢气发生化合 |
下列离子方程式正确的是( )
| A、氨气通入醋酸溶液:CH3COOH+NH3═CH3COONH4 |
| B、亚硫酸氢钠溶液呈酸性:HSO3-+H2O?H3O++SO32- |
| C、氢氧化铁溶于氢碘酸中:Fe(OH)3+3H+═Fe3++3H2O |
| D、稀硝酸洗涤试管内壁的银镜:Ag+2H++NO3-═Ag++NO↑+H2O |
短周期元素M、W、X、Y、Z在元素周期表中的位置如图所示,其中M、W、X的原子序数之和等于30.下列判断正确的是( )
| M | W | |
| X | Y | Z |
| A、M的氢化物与Z的氢化物反应所得产物的水溶液呈中性 |
| B、最高价氧化物的水化物的酸性H3XO4强于HMO3 |
| C、X与Z形成的所有化合物分子中,各原子均满足8电子稳定结构 |
| D、Y与Z的最高正化合价之和的数值等于13 |
 图中,“-”表示相连的物质间在一定条件下可以反应,“→”表示丁在一定条件下可以转化为乙.下面四组选项中,符合图示要求的是( )
图中,“-”表示相连的物质间在一定条件下可以反应,“→”表示丁在一定条件下可以转化为乙.下面四组选项中,符合图示要求的是( )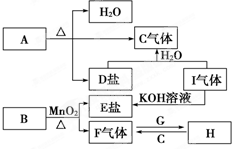 已知A、B、C、D、E、F、G、H、I九种物质,其中A、B、D、E焰色反应均为紫色(透过蓝色钴玻璃),G、F是单质,其余均为化合物,H是一种淡黄色固体,它们的转化关系如图所示.请回答:(提示:实验室制氧气可用氯酸钾与二氧化锰[作催化剂]混合加热制取)
已知A、B、C、D、E、F、G、H、I九种物质,其中A、B、D、E焰色反应均为紫色(透过蓝色钴玻璃),G、F是单质,其余均为化合物,H是一种淡黄色固体,它们的转化关系如图所示.请回答:(提示:实验室制氧气可用氯酸钾与二氧化锰[作催化剂]混合加热制取)