��Ŀ����
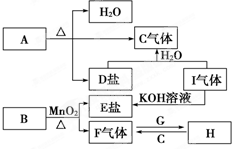 ��֪A��B��C��D��E��F��G��H��I�������ʣ�����A��B��D��E��ɫ��Ӧ��Ϊ��ɫ������ɫ�ܲ�������G��F�ǵ��ʣ������Ϊ�����H��һ�ֵ���ɫ���壬���ǵ�ת����ϵ��ͼ��ʾ����ش𣺣���ʾ��ʵ����������������������������[������]��ϼ�����ȡ��
��֪A��B��C��D��E��F��G��H��I�������ʣ�����A��B��D��E��ɫ��Ӧ��Ϊ��ɫ������ɫ�ܲ�������G��F�ǵ��ʣ������Ϊ�����H��һ�ֵ���ɫ���壬���ǵ�ת����ϵ��ͼ��ʾ����ش𣺣���ʾ��ʵ����������������������������[������]��ϼ�����ȡ����1������G���ӽṹʾ��ͼ
��2��д��B��I�Ļ�ѧʽB
��3��д��H��һ����;
��4��д��A���ȷֽ�Ļ�ѧ����ʽ
��5����H��C��Ӧ��������4.2g����μӷ�Ӧ��C�����ڱ�״���µ����Ϊ
���㣺������ƶ�
ר�⣺�ƶ���
������A��B��C��D��E��F��G��H��I�������ʣ�����A��B��D��E��ɫ��Ӧ��Ϊ��ɫ������ɫ�ܲ�������˵�����м�Ԫ�أ�F�ǵ��ʣ�B�Ͷ��������ڼ����������������嵥�ʣ���BΪKClO3��FΪO2��EΪKCl��G�ǵ��ʣ�
HΪ����ɫ���壬Na��������ȼ�����ɹ������ƣ�����G��Na��HΪNa2O2��C�����壬�������ƺͶ�����̼��Ӧ��������������C��CO2��̼���κ��ᷴӦ���ɶ�����̼��A���ȷֽ����ɶ�����̼��ˮ��̼���Σ�A�к��м�Ԫ�أ�����A��KHCO3��D��K2CO3��I��KOH��Ӧ����KCl������IΪHCl���壬�ݴ˷������
HΪ����ɫ���壬Na��������ȼ�����ɹ������ƣ�����G��Na��HΪNa2O2��C�����壬�������ƺͶ�����̼��Ӧ��������������C��CO2��̼���κ��ᷴӦ���ɶ�����̼��A���ȷֽ����ɶ�����̼��ˮ��̼���Σ�A�к��м�Ԫ�أ�����A��KHCO3��D��K2CO3��I��KOH��Ӧ����KCl������IΪHCl���壬�ݴ˷������
���
�⣺A��B��C��D��E��F��G��H��I�������ʣ�����A��B��D��E��ɫ��Ӧ��Ϊ��ɫ������ɫ�ܲ�������˵�����м�Ԫ�أ�F�ǵ��ʣ�B�Ͷ��������ڼ����������������嵥�ʣ���BΪKClO3��FΪO2��EΪKCl��G�ǵ��ʣ�
HΪ����ɫ���壬Na��������ȼ�����ɹ������ƣ�����G��Na��HΪNa2O2��C�����壬�������ƺͶ�����̼��Ӧ��������������C��CO2��̼���κ��ᷴӦ���ɶ�����̼��A���ȷֽ����ɶ�����̼��ˮ��̼���Σ�A�к��м�Ԫ�أ�����A��KHCO3��D��K2CO3��I��KOH��Ӧ����KCl������IΪHCl���壬
��1��Gԭ�Ӻ�����3�����Ӳ㡢������������1����ԭ��ʧȥ1���������������ӣ����������ӽṹʾ��ͼ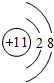 ���ʴ�Ϊ��
���ʴ�Ϊ��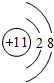 ��
��
��2��ͨ�����Ϸ���֪��B��I�Ļ�ѧʽ�ֱ�ΪKClO3��HCl���ʴ�Ϊ��KClO3��HCl��
��3��H�ǹ������ƣ�H��һ����;�ǿ����ں�����ߺ�DZˮͧ����Ϊ��������Դ������Ư��֯��ʴ�Ϊ�������ں�����ߺ�DZˮͧ����Ϊ��������Դ������Ư��֯�
��4�����������£�̼����طֽ�����̼��ء�������̼��ˮ����Ӧ����ʽΪ2KHCO3
K2CO3+CO2��+H2O���ʴ�Ϊ��2KHCO3
K2CO3+CO2��+H2O��
��5���������ƺͶ�����̼��Ӧ����ʽΪ2Na2O2+2CO2=2Na2CO3+O2����������ת��Ϊ̼����ʱ�������������ӵ����൱��CO����μӷ�Ӧ�Ķ�����̼���ʵ���Ϊx��
2Na2O2+2CO2=2Na2CO3+O2������������
2mol 56g
x 4.2g
2mol��56g=x��4.2g
x=
=0.15mol��
������̼���=0.15mol��22.4L/mol=3.36L��
�ʴ�Ϊ��3.36��
HΪ����ɫ���壬Na��������ȼ�����ɹ������ƣ�����G��Na��HΪNa2O2��C�����壬�������ƺͶ�����̼��Ӧ��������������C��CO2��̼���κ��ᷴӦ���ɶ�����̼��A���ȷֽ����ɶ�����̼��ˮ��̼���Σ�A�к��м�Ԫ�أ�����A��KHCO3��D��K2CO3��I��KOH��Ӧ����KCl������IΪHCl���壬
��1��Gԭ�Ӻ�����3�����Ӳ㡢������������1����ԭ��ʧȥ1���������������ӣ����������ӽṹʾ��ͼ
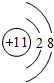 ���ʴ�Ϊ��
���ʴ�Ϊ��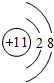 ��
����2��ͨ�����Ϸ���֪��B��I�Ļ�ѧʽ�ֱ�ΪKClO3��HCl���ʴ�Ϊ��KClO3��HCl��
��3��H�ǹ������ƣ�H��һ����;�ǿ����ں�����ߺ�DZˮͧ����Ϊ��������Դ������Ư��֯��ʴ�Ϊ�������ں�����ߺ�DZˮͧ����Ϊ��������Դ������Ư��֯�
��4�����������£�̼����طֽ�����̼��ء�������̼��ˮ����Ӧ����ʽΪ2KHCO3
| ||
| ||
��5���������ƺͶ�����̼��Ӧ����ʽΪ2Na2O2+2CO2=2Na2CO3+O2����������ת��Ϊ̼����ʱ�������������ӵ����൱��CO����μӷ�Ӧ�Ķ�����̼���ʵ���Ϊx��
2Na2O2+2CO2=2Na2CO3+O2������������
2mol 56g
x 4.2g
2mol��56g=x��4.2g
x=
| 4.2g��2mol |
| 56g |
������̼���=0.15mol��22.4L/mol=3.36L��
�ʴ�Ϊ��3.36��
������������Ԫ�ػ�����֪ʶ���������ƶϣ���Ԫ����ɫ��Ӧ��������ɫ����Ӧ����������״̬Ϊͻ�ƿڲ��������ϵķ��������ƶϣ���5�������ò����������Ŀ�ѶȲ���

��ϰ��ϵ�д�
 ��У����ϵ�д�
��У����ϵ�д�
�����Ŀ
�����������Ʒֱ�Ͷ���������ʵ�ˮ��Һ�У�������ų�������Һ����������ǣ�������
| A��HCl |
| B��ϡK2SO4��Һ |
| C��FeCl3 |
| D��ϡNaOH��Һ |
0.1mol NaHCO3���������
| A��0.2 mol Na+ |
| B��0.05 mol CO |
| C��6.02��1023�� O |
| D��0.1 mol H |
���и�ѡ�����X��Y�������ʣ���X�������루ͨ�룩Y��Һ�У�����X�Ƿ������������ͬһ���ӷ���ʽ��ʾ���ǣ�������
| X | Y | |
| A | ϡ���� | ̼������Һ |
| B | ƫ��������Һ | ������Һ |
| C | ������Һ | �Ȼ�����Һ |
| D | һˮ�ϰ� | �Ȼ�����Һ |
| A��A | B��B | C��C | D��D |
���з����м��Dz���120����ǣ�������
| A��C2H2 |
| B��C6H6 |
| C��BF3 |
| D��NH3 |