题目内容
2.用石墨作电极,电解1mol•L-1下列物质的溶液,溶液pH变大的是( )| A. | HCl | B. | H2SO4 | C. | NaCl | D. | Na2SO4 |
分析 用石墨作电极电解下列电解质溶液,
A.如果电解质是HCl,阴极上H+放电,阳极上是OH-放电,实质上是电解H2O;
B.电解H2SO4溶液,阴极H+放电,阳极上是OH-放电,实质上是电解H2O
C.电解NaCl溶液,阴极上H2O得电子生成H2和OH-,阳极上Cl-放电生成Cl2;
D.电解Na2SO4溶液,阴极上H+放电,阳极上是OH-放电,实质上是电解H2O.
解答 解:用石墨作电极电解下列电解质溶液,
A.如果电解质是HCl,阴极上H+放电,阳极上是OH-放电,实质上是电解H2O,溶质的物质的量不变,但溶液体积减小,导致c(HCl)浓度增大,pH减小,故A错误;
B.电解H2SO4溶液,阴极H+放电,阳极上是OH-放电,实质上是电解H2O,溶质的物质的量不变,但溶液体积减小,导致c(H2SO4)浓度增大,pH减小,故B错误;
C.电解NaCl溶液,阴极上H2O得电子生成H2和OH-,阳极上Cl-放电生成Cl2,有NaOH生成,导致溶液pH增大,故C正确;
D.电解Na2SO4溶液,阴极上H+放电,阳极上是OH-放电,实质上是电解H2O,溶质的物质的量不变,但溶液体积减小,导致c(Na2SO4)浓度增大,硫酸钠是强酸强碱盐其溶液呈中性,所以电解后溶液仍然呈中性,故D错误;
故选C.
点评 本题考查电解原理,为高频考点,明确离子放电顺序是解本题关键,知道电解后溶液中溶质及其浓度变化即可解答,题目难度不大.

练习册系列答案
 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案
相关题目
10.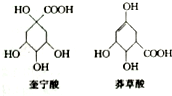 奎宁酸和莽草酸是某些高等植物特有的脂环状有机酸,常共存在一起,其结构简式如图所示.下列说法不正确的是( )
奎宁酸和莽草酸是某些高等植物特有的脂环状有机酸,常共存在一起,其结构简式如图所示.下列说法不正确的是( )
 奎宁酸和莽草酸是某些高等植物特有的脂环状有机酸,常共存在一起,其结构简式如图所示.下列说法不正确的是( )
奎宁酸和莽草酸是某些高等植物特有的脂环状有机酸,常共存在一起,其结构简式如图所示.下列说法不正确的是( )| A. | 奎宁酸的相对分子质量比莽草酸的大18 | |
| B. | 可用高锰酸钾溶液鉴别奎宁酸和莽草酸 | |
| C. | 等物质的量的奎宁酸和莽草酸分别与足量Na反应,同温同压下产生H2的体积比为5:4 | |
| D. | 等物质的量的两种分别与足量NaOH溶液反应,消耗NaOH的物质的量相同 |
17.在2A+B?3C+5D反应中,表示该反应速率最快的是( )
| A. | V(A)=2.0mol/(L•s) | B. | V(B)=1.2mol/(L•s) | C. | V(C)=3.2mol/(L•s) | D. | V(D)=4.0 mol/(L•s) |
14.某主族元素R的最高正化合价与最低负化合价的代数和为4,由此可以判断( )
| A. | R一定有4个电子层 | |
| B. | R原子的最外层电子数一定为6 | |
| C. | R的气态氢化物比电子层数相同的其他非金属元素的气态氢化物稳定 | |
| D. | R气态氢化物化学式为H2R |
9.25℃时,在pH=1的溶液中可以大量共存的离子组是( )
| A. | K+、Na+、HCO3-、NO3- | B. | Na+、K+、SO42-、Cl- | ||
| C. | Ba2+、Mg2+、SO42-、NO3- | D. | Fe2+、K+、NO3-、Na+ |
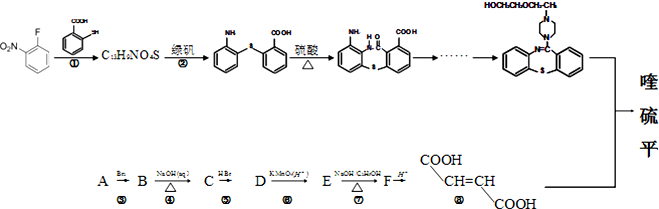
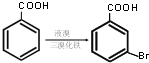 写出以甲苯为原料制备
写出以甲苯为原料制备 的合成路线.
的合成路线.