题目内容
某实验兴趣小组用0.1000mol/L的标准盐酸溶液测定未知NaOH溶液,进行了4次中和滴定,数据如下:该待测NaOH的浓度为( )
| 实验序号 | 待测液数据/mL | 标准液数据/mL | ||
| 滴定前 | 滴定后 | 取用前 | 取用后 | |
| 1 | 0.10 | 20.10 | 0.00 | 20.00 |
| 2 | 0.80 | 22.60 | 0.00 | 20.00 |
| 3 | 0.40 | 20.20 | 0.00 | 20.00 |
| 4 | 1.20 | 21.40 | 0.00 | 20.00 |
| A、0.1000 mol/L |
| B、0.0978 mol/L |
| C、0.9780 mol/L |
| D、0.1020 mol/L |
考点:中和滴定
专题:实验题
分析:先判断数据的有效性,再根据关系式NaOH~HCl求出氢氧化钠的物质的量浓度;
解答:
解:4次消耗的待测液的体积分别为20.00mLmLmL,21.80mLmLmL,19.80mLmLmL,20.20mLmLmL,第三组数据相差较大,舍去,其他三次实验的平均值为
=20.00mL,
NaOH~HCl
1 1
C(NaOH)×20.00mL 0.1000mol/L×20.00mL
解得:C(NaOH)=0.1000mol/L;
故选A.
| 20.00mL+19.80mL+20.20mL |
| 3 |
NaOH~HCl
1 1
C(NaOH)×20.00mL 0.1000mol/L×20.00mL
解得:C(NaOH)=0.1000mol/L;
故选A.
点评:本题考查了滴定操作,掌握反应的关系式是解题的关键,注意数据的处理.

练习册系列答案
相关题目
下列装置或操作能达到实验目的是( )
A、 配制一定浓度溶液 |
B、 中和热测定 |
C、 铁的析氢腐蚀 |
D、 验证氨气易容于水 |
在一定温度下可逆反应H2(g)+I2(g)?2HI(g) 达到平衡的标志是( )
| A、有1mol H-H键断裂,同时有1 mol I-I键形成 |
| B、容器内压强不再随时间而变化 |
| C、υ正(H2)=υ逆(HI) |
| D、H2、I2、HI的浓度之比为1:1:2 |


 ),在一定条件下能发生银镜反应,且1molE最多可得到4molAg;
),在一定条件下能发生银镜反应,且1molE最多可得到4molAg;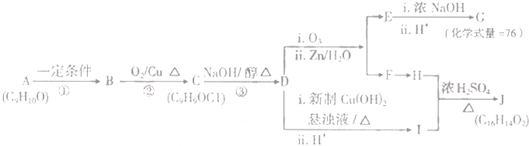
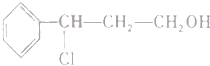




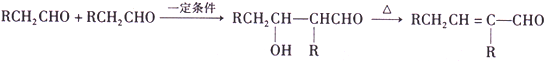
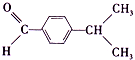 )合成兔耳草醛的路线如下:
)合成兔耳草醛的路线如下: