题目内容
19.三草酸合铁酸钾晶体(K3[Fe(C2O4)3]•xH2O)是一种光敏材料,在110℃可完全失去结晶水.为测定该晶体中铁的含量,某实验小组做了如下实验:Ⅰ.称量4.910g三草酸合铁酸钾晶体,配制成250mL溶液.
Ⅱ.取所配溶液25.00mL于锥形瓶中,加稀硫酸酸化,滴加KMnO4溶液至草酸根(C2O42-)
恰好全部氧化成二氧化碳,同时MnO4-被还原成Mn2+.向反应后的溶液中加入一小匙锌粉,加热至溶液的黄色刚好消失,过滤,洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时,溶液仍呈酸性.
Ⅲ.用0.01000mol/L KMnO4溶液滴定步骤Ⅱ所得溶液至终点,消耗KMnO4溶液20.02mL,滴定中MnO4-被还原成Mn2+.
Ⅳ.重复步骤Ⅱ、步骤Ⅲ操作,滴定消耗0.01000mol/L KMnO4溶液19.98mL
请回答下列问题:
(1)滴定过程中需添加的指示剂是(若不需要请说明理由)不需要,MnO4-紫色有颜色变化
(2)加入锌粉的目的是将Fe3+还原成Fe2+.
(3)写出步骤Ⅲ中发生反应的离子方程式5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O.
(4)实验测得该晶体中铁的质量分数为11.41%;X=3.
(5)在步骤Ⅱ中,若加入的KMnO4的溶液的量不够,则测得的铁含量偏高;(选填“偏低”“偏高”“不变”,下同)若加入的锌粉的量不够,则测的铁的含量偏低.
分析 (1)KMnO4溶液本身为紫红色,不需要指示剂指示反应的终点;
(2)由步骤Ⅲ可知,利用高锰酸钾测定亚铁离子,故加入锌粉的目的是将Fe3+恰好还原成Fe2+,为进一步测定铁元素的含量做准备;
(3)亚铁离子与高锰酸根在酸性条件下反应生成铁离子、锰离子与水,配平书写方程式;
(4)根据离子方程式计算,n(Fe)=5n(MnO4-),可以计算m(Fe),然后可以计算晶体中铁的质量分数,根据4.910g三草酸合铁酸钾晶体中n(K3[Fe(C2O4)3]):n(H2O)=1:x计算x的值;
(5)若在步骤Ⅱ中滴入酸性高锰酸钾溶液不足,则会有部分草酸根离子未被氧化,在步骤Ⅲ中则会造成消耗酸性高锰酸钾溶液的量偏大,从而计算出的铁的量增多,含量偏高,若加入的锌粉的量不够,部分Fe3+未被还原成Fe2+,则测的铁的含量偏低.
解答 解:(1)高锰酸钾溶液为紫红色,可以利用溶液颜色变化来指示反应的终点,不需要指示剂,高锰酸钾溶液呈紫色和亚铁离子反应到恰好反应后滴入最后一滴高锰酸钾溶液紫色半分钟不褪色为反应终点,
故答案为:不需要,MnO4-紫色有颜色变化;
(2)由步骤Ⅲ可知,利用高锰酸钾测定亚铁离子,故加入锌粉的目的是将Fe3+恰好还原成Fe2+,为进一步测定铁元素的含量做准备,
故答案为:将Fe3+还原成Fe2+;
(3)高锰酸钾在酸性溶液中具有强氧化性能氧化亚铁离子为铁离子,本身被还原为锰离子,Mn元素的化合价由+7价降低为+2价,Fe元素的化合价由+2价升高为+3价,由电子守恒、电荷守恒、原子守恒可知,发生的离子反应为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O,
故答案为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O;
(4)根据离子方程式计算,n(Fe)=5n(MnO4-)=5×$\frac{20.02+19.98}{2}$×0.01×10-3×10=1.0×10-2mol,m(Fe)=56 g•mol-1×1.0×10-2mol=0.56g.晶体中铁的质量分数=$\frac{0.56g}{4.910g}$×100%≈11.41%,三草酸合铁酸钾的摩尔质量M(K3[Fe(C2O4)3])=437g•mol-1,4.910gK3[Fe(C2O4)3]•xH2O中K3[Fe(C2O4)3]质量m=nM=1.0×10-2mol×437g•mol-1=4.37g,含水的物质的量为n=$\frac{4.91g-4.37g}{18g/mol}$=0.03mol,n(K3[Fe(C2O4)3]):n(H2O)=1:x=0.01mol:0.03mol,x=3,
故答案为:11.41%;3;
(5)步骤Ⅱ中滴入酸性高锰酸钾溶液不足,则会有部分草酸根离子未被氧化,在步骤Ⅲ中则会造成消耗酸性高锰酸钾溶液的量偏大,从而计算出的铁的量增多,含量偏高,反之,若加入的锌粉的量不够,部分Fe3+未被还原成Fe2+,则测的铁的含量偏低,
故答案为:偏高;偏低.
点评 本题考查较为综合,涉及到溶液的配制、滴定和结晶等操作,注意基础实验知识的积累,把握实验步骤、原理和注意事项等问题,题目难度中等.

 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案| A. | 甲烷、乙烯、苯都可通过石油分馏得到 | |
| B. | 乙醇既能与有机化合物反应又能与无机化合物反应 | |
| C. | 煤焦油、石油、花生油都属于烃 | |
| D. | 鸡蛋清中加入饱和(NH4)2SO4溶液会使蛋白质失去生理活性 |
| A. | 乙烯催化加水制取工业酒精 | |
| B. | 酒精和浓硫酸混合后缓慢加热制取乙烯 | |
| C. | 甲烷和氯气在光照条件下制取氯仿 | |
| D. | 碱石灰和醋酸钠晶体制取甲烷 |
| A. | 乙烷、乙醇和乙酸都可以与钠反应生成氢气 | |
| B. | 石油分馏可获得甲烷、乙烯、苯等 | |
| C. | 苯和乙烯都可以使溴的四氯化碳溶液褪色 | |
| D. |  已知上海世博会永久性标志建筑之-上海世博轴(如图)的上层巨型膜结构ETFE由单体乙烯和四氟乙烯加聚而成:其结构简式为: 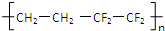 |
| A. | 升高温度 | B. | 使用催化剂 | C. | 增大H2浓度 | D. | 减小压强 |
①钠和水反应生成NaOH和H2;所有金属与水反应都生成碱和H2
②化合物NaCl的焰色为黄色;Na2CO3的焰色也为黄色
③铁露置在空气中一段时间后就会生锈;性质更活泼的铝露置在空气中也很容易腐蚀
④CO2、SO2等酸性氧化物均能与碱反应,不与酸反应;SiO2也不与所有的酸反应
⑤SO2能使酸性高锰酸钾溶液褪色,所以说SO2具有漂白性.
| A. | ①③④⑤ | B. | ②④ | C. | ①③⑤ | D. | ①②③④⑤ |
| A. | 混合体系中气体密度发生变化 | B. | 正、逆反应速率改变 | ||
| C. | 混合物中各组分的浓度改变 | D. | 反应物的转化率改变 |
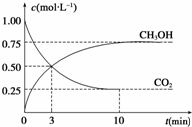 新华社2009年10月15日报道:全国农村应当在“绿色生态-美丽多彩-低碳节能-循环发展”的理念引导下,更好更快地发展“中国绿色村庄”,参与“亚太国际低碳农庄”建设.可见“低碳循环”已经引起了国民的重视,试回答下列问题:
新华社2009年10月15日报道:全国农村应当在“绿色生态-美丽多彩-低碳节能-循环发展”的理念引导下,更好更快地发展“中国绿色村庄”,参与“亚太国际低碳农庄”建设.可见“低碳循环”已经引起了国民的重视,试回答下列问题: