题目内容
6.设NA表示阿伏加德罗常数,下列说法正确的是( )| A. | 1mol18O2所含中子数为16NA | |
| B. | 100mL pH=3的醋酸溶液中,氢离子数目小于10-4NA | |
| C. | 0.5mol铝分别与足量烧碱和盐酸反应转移的电子数相等,均为1.5NA | |
| D. | 标准状况下,11.2L SO3所含分子数为0.5NA |
分析 A.1个18O含有10个中子;
B.pH=3的醋酸溶液中,c(H+)=10-3mol/L,依据N=nNA计算氢离子个数;
C.依据电子守恒分析计算应;
D.标况下三氧化硫不是气体.
解答 解:A.1mol18O2所含中子数为20NA,故A错误;
B.100mL pH=3的醋酸溶液中,氢离子数目=10-3mol/L×0.1L×NA=10-4NA,故B错误;
C.0.5mol铝分别与足量烧碱和盐酸反应,铝都是从0价升高为+3价,所以转移电子数相等,故C正确;
D.标况下三氧化硫不是气体,不能使用气体摩尔体积,故D错误;
故选:C.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,明确物质的结构特点是解题关键,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
1. A、B、C分别是三种常见的金属或非金属的单质;D、E、F则是常见的三种氧化物,且有如下所示的转化关系.下列说法中错误的是( )
A、B、C分别是三种常见的金属或非金属的单质;D、E、F则是常见的三种氧化物,且有如下所示的转化关系.下列说法中错误的是( )
 A、B、C分别是三种常见的金属或非金属的单质;D、E、F则是常见的三种氧化物,且有如下所示的转化关系.下列说法中错误的是( )
A、B、C分别是三种常见的金属或非金属的单质;D、E、F则是常见的三种氧化物,且有如下所示的转化关系.下列说法中错误的是( )| A. | D、E中一定都含有A元素 | B. | 单质B肯定是氧化剂 | ||
| C. | A、B、C中一定有一种是O2 | D. | 若A是非金属,则B一定为金属 |
11.元素周期表是学习化学的重要工具,它隐含着许多信息和规律.如表所列是五种短周期的原子半径及主要化合价(已知铍的原子半径为0.089nm)
(1)C的氢化物的结构式为H-S-H.
(2)B的最高价氧化物的水化物与C的最高价氧化物的水化物反应的离子方程式为:Al(OH)3+3H+=Al3+3H2O;
(3)上述五种元素的最高价氧化物对应水化物的酸性最强的是HClO4(填化学式)
(4)C和E形成的化合物的化学式分别为SO2、SO3.
(5)A和D所形成化合物的晶体类型:离子晶体.
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.16 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | -1 | -2 |
(2)B的最高价氧化物的水化物与C的最高价氧化物的水化物反应的离子方程式为:Al(OH)3+3H+=Al3+3H2O;
(3)上述五种元素的最高价氧化物对应水化物的酸性最强的是HClO4(填化学式)
(4)C和E形成的化合物的化学式分别为SO2、SO3.
(5)A和D所形成化合物的晶体类型:离子晶体.
18.下列说法正确的是( )
| A. | 生物质能来源于植物机体加工产品所贮存的能量,绿色植物通过光合作用将化学能转化为生物质能 | |
| B. | 铝硅酸盐分子筛可用于物质分离,还可用作干燥剂、催化剂及催化剂载体 | |
| C. | 人体从食物中摄取蛋白质,在体内先水解成各种氨基酸,经过不断的分解,最终生成水和二氧化碳排出体外 | |
| D. | 铁盐会水解产生具有吸附性的胶体粒子,可用于饮用水的杀菌消毒 |
15. NaCl和NaClO在酸性条件下可发生反应:ClO-+Cl-+2H+═Cl2↑+H2O,某学习小组拟研究消毒液(主要成分为NaCl和NaClO)的变质情况.
NaCl和NaClO在酸性条件下可发生反应:ClO-+Cl-+2H+═Cl2↑+H2O,某学习小组拟研究消毒液(主要成分为NaCl和NaClO)的变质情况.
(1)此消毒液中NaClO可吸收空气中的CO2生成NaHCO3和HClO而变质.写出化学反应方程式:NaClO+CO2+H2O=NaHCO3+HClO.
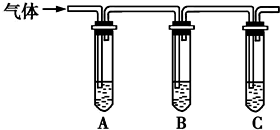
(2)取适量消毒液放在试管中,加入足量一定浓度的硫酸,有气体放出.通过如图所示装置检验气体的成分,从而判断该消毒液是否变质.
限选试剂:98%浓硫酸、1%品红溶液、1.0mol•L-1 KI-淀粉溶液、1.0mol•L-1NaOH溶液、澄清石灰水、饱和NaCl溶液.
请完成下列实验方案(如图).
(3)用滴定法测定消毒液中NaClO的浓度.实验步骤如下:
①量取 25.00mL消毒液放入锥形瓶中,加入过量的a mol•L-1 Na2SO3溶液b mL.
②滴定分析.将c mol•L-1的酸性KMnO4溶液装入酸式(填“酸式”或“碱式”)滴定管中滴定,使KMnO4和剩余的Na2SO3发生反应.当溶液由无色变成浅红色,且半分钟内红色保持不褪去时,停止滴定,记录数据.重复滴定实验3次,测得平均消耗酸性KMnO4溶液V mL;滴定过程中涉及的反应有:NaClO+Na2SO3═NaCl+Na2SO4;2KMnO4+5Na2SO3+3H2SO4═K2SO4+2MnSO4+5Na2SO4+3H2O.
③计算.消毒液中NaClO的浓度为$\frac{2ab-5vc}{50}$mol•L-1(用含a、b、c、V的代数式表示).
 NaCl和NaClO在酸性条件下可发生反应:ClO-+Cl-+2H+═Cl2↑+H2O,某学习小组拟研究消毒液(主要成分为NaCl和NaClO)的变质情况.
NaCl和NaClO在酸性条件下可发生反应:ClO-+Cl-+2H+═Cl2↑+H2O,某学习小组拟研究消毒液(主要成分为NaCl和NaClO)的变质情况.(1)此消毒液中NaClO可吸收空气中的CO2生成NaHCO3和HClO而变质.写出化学反应方程式:NaClO+CO2+H2O=NaHCO3+HClO.
(2)取适量消毒液放在试管中,加入足量一定浓度的硫酸,有气体放出.通过如图所示装置检验气体的成分,从而判断该消毒液是否变质.
限选试剂:98%浓硫酸、1%品红溶液、1.0mol•L-1 KI-淀粉溶液、1.0mol•L-1NaOH溶液、澄清石灰水、饱和NaCl溶液.
请完成下列实验方案(如图).
| 所加试剂 | 预期现象和结论 |
| 向试管A中加足量①1.0mol/LK淀粉溶液; 试管B中加1%品红溶液; 试管C中加②澄清石灰水. | 若A中溶液变蓝色,B中溶液不褪色,C中溶液变浑浊,则消毒液部分变质; ③若A中溶液变蓝色,B中溶液不退色(无变化),C中溶液不变浑浊(无变化),则消毒液未变质,则消毒液未变质; ④若A中溶液不变蓝色(无变化),B中溶液不退色(无变化),C中溶液变浑浊则消毒液完全变质,则消毒液完全变质. |
①量取 25.00mL消毒液放入锥形瓶中,加入过量的a mol•L-1 Na2SO3溶液b mL.
②滴定分析.将c mol•L-1的酸性KMnO4溶液装入酸式(填“酸式”或“碱式”)滴定管中滴定,使KMnO4和剩余的Na2SO3发生反应.当溶液由无色变成浅红色,且半分钟内红色保持不褪去时,停止滴定,记录数据.重复滴定实验3次,测得平均消耗酸性KMnO4溶液V mL;滴定过程中涉及的反应有:NaClO+Na2SO3═NaCl+Na2SO4;2KMnO4+5Na2SO3+3H2SO4═K2SO4+2MnSO4+5Na2SO4+3H2O.
③计算.消毒液中NaClO的浓度为$\frac{2ab-5vc}{50}$mol•L-1(用含a、b、c、V的代数式表示).
16.一种熔融碳酸盐燃料电池原理示意如图所示
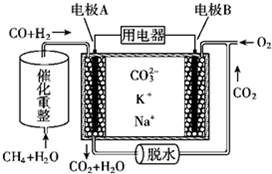
下列说法不正确的是( )

下列说法不正确的是( )
| A. | 电池工作时,K+向B极移动 | |
| B. | 电极B上发生的电极反应:O2+2CO2+4e-═2CO32- | |
| C. | 电池工作时,CO2可以循环利用 | |
| D. | 消耗1molCH4催化重整得到的CO和H2通入电极A,需要电极B同时通入33.6L的O2 |
 已知某烃A的产量是衡量一个国家石油化工水平的标志,能发生下列转化关系(部分反应物或生成物及反应条件已略去):
已知某烃A的产量是衡量一个国家石油化工水平的标志,能发生下列转化关系(部分反应物或生成物及反应条件已略去):