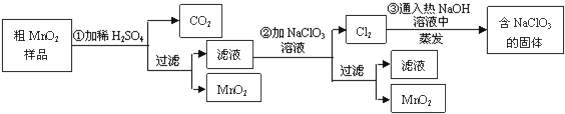
题目内容
4.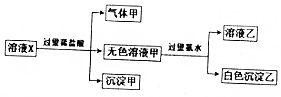 水溶液中只可能有K+、Mg2+、AlO2-、Al3+、SiO32-、CO32-、SO42-中的若干种离子,某同学对溶液进行了如下实验:下列判断错误的是( )
水溶液中只可能有K+、Mg2+、AlO2-、Al3+、SiO32-、CO32-、SO42-中的若干种离子,某同学对溶液进行了如下实验:下列判断错误的是( )| A. | 溶液X可能含有Mg2+或Al3+ | |
| B. | 沉淀甲只可能是硅酸沉淀 | |
| C. | 有气体甲生成,表明溶液X中一定含有CO32- | |
| D. | 不能确定SO42-是否存在于溶液X中 |
分析 溶液X中进入过量盐酸,生成的气体甲,气体甲为二氧化碳,则原溶液中含有CO32-,根据离子共存可知溶液中一定不存在Mg2+、Al3+;再根据溶液电中性可知,原溶液中一定存在唯一的阳离子K+;
加入盐酸生成了沉淀甲,该沉淀只能为硅酸,原溶液中一定存在SiO32-;
无色溶液甲中加入过量氨水,得到的白色沉淀,该沉淀为氢氧化铝,说明原溶液中一定存在AlO2-,白色沉淀乙为氢氧化铝,据此进行解答.
解答 解:溶液X中进入过量盐酸,生成的气体甲,气体甲为二氧化碳,则原溶液中含有CO32-,根据离子共存可知溶液中一定不存在Mg2+、Al3+;再根据溶液电中性可知,原溶液中一定存在唯一的阳离子K+;
加入盐酸生成了沉淀甲,该沉淀只能为硅酸,原溶液中一定存在SiO32-;
无色溶液甲中加入过量氨水,得到的白色沉淀,该沉淀为氢氧化铝,说明原溶液中一定存在AlO2-,白色沉淀乙为氢氧化铝,
A.根据分析可知,溶液X中一定不存在Mg2+、Al3+,故A错误;
B.白色沉淀只能为硅酸根离子与氢离子反应生成的硅酸,故B正确;
C.只有CO32-与稀盐酸反应生成二氧化碳,表明溶液X中一定含有CO32-,故C正确;
D.根据分析可知,无法确定原溶液中是否含有硫酸根离子,故D正确;
故选A.
点评 本题考查常见离子的检验方法,题目难度中等,注意掌握常见离子的性质及检验方法,要求学生能够根据反应现象判断离子存在情况,试题有利于提高学生的分析能力及逻辑推理能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
14.下列成语或俗语涉及化学变化的是( )
| A. | 滴水成冰 | B. | 聚沙成塔 | C. | 火上浇油 | D. | 铁杵磨成针 |
15.已知元素X,Y的核电荷数分别为a和b,它们的离子Xn+的Ym-的核外电子排布完全相同,则下列关系中正确的是( )
| A. | a+m=b-n | B. | a+b=m+n | C. | a-m=b+n | D. | a+m=b-n |
12. 在某温度下、容积均为2L的三个密闭容器中,按不同方式投入反应物,保持恒温恒容,使之发生反应:2H2(g)+CO(g)?CH3OH(g)△H=-dkJ•mol-1(d>0).初始投料与各容器达到平衡时的有关数据如表:
在某温度下、容积均为2L的三个密闭容器中,按不同方式投入反应物,保持恒温恒容,使之发生反应:2H2(g)+CO(g)?CH3OH(g)△H=-dkJ•mol-1(d>0).初始投料与各容器达到平衡时的有关数据如表:
(1)该温度下此反应的平衡常数K为4.
(2)三个容器中的反应分别达平衡时各组数据关系正确的是AB
A.α1+α2=1 B.Q1+Q2=d C.α3<α1
D.P3>2P1=2P2 E.n2<n3<1.0mol F.Q3<2Q1
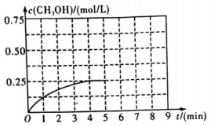
(3)在其他条件不变的情况下,在第5min 时将甲容器的体系体积压缩到1L,若在第8min达到新的平衡,从0min开始到新平衡时H2的转化率为65.5%,请在图中画出第5min到新平衡时CH3OH的物质的量浓度的变化曲线.
 在某温度下、容积均为2L的三个密闭容器中,按不同方式投入反应物,保持恒温恒容,使之发生反应:2H2(g)+CO(g)?CH3OH(g)△H=-dkJ•mol-1(d>0).初始投料与各容器达到平衡时的有关数据如表:
在某温度下、容积均为2L的三个密闭容器中,按不同方式投入反应物,保持恒温恒容,使之发生反应:2H2(g)+CO(g)?CH3OH(g)△H=-dkJ•mol-1(d>0).初始投料与各容器达到平衡时的有关数据如表:| 实验 | 甲 | 乙 | 丙 |
| 初始投料 | 2mol H2、1mol CO | 1mol CH3OH | 4mol H2、2mol CO |
| 平衡时n(CH3OH) | 0.5mol | n2 | n3 |
| 反应的能量变化 | 放出Q1KJ | 吸收Q2KJ | 放出Q3KJ |
| 体系的压强 | P1 | P2 | P3 |
| 反应物的转化率 | α1 | α2 | α3 |
(2)三个容器中的反应分别达平衡时各组数据关系正确的是AB
A.α1+α2=1 B.Q1+Q2=d C.α3<α1
D.P3>2P1=2P2 E.n2<n3<1.0mol F.Q3<2Q1
(3)在其他条件不变的情况下,在第5min 时将甲容器的体系体积压缩到1L,若在第8min达到新的平衡,从0min开始到新平衡时H2的转化率为65.5%,请在图中画出第5min到新平衡时CH3OH的物质的量浓度的变化曲线.
19.Ⅰ几种短周期元素的原子半径及主要化合价如表:已知X是短周期中最活泼的金属,且与R同周期.(请用化学用语答题)
(1)R的元素符号为Al; M在元素周期表中的位置为第二周期第VIA族.
(2)X与Y按原子个数比1:1构成的物质的电子式为 ;所含化学键类型离子键、共价键.
;所含化学键类型离子键、共价键.
(3)X+,Y2?,M2?离子半径大小顺序为S2?>O2?>Na+.
(4)将YM2通入FeCl3溶液中的离子方程式2H2O+SO2+2Fe3+=2Fe2++SO42-+4H+.
(5)用Cu单质作阳极,石墨作阴极,X的最高价氧化物对应的水化物溶液作电解液进行电解,写出阳极的反应式Cu+2OH?-2e?=Cu(OH)2.
Ⅱ如图转化关系A$\stackrel{+X}{→}$B$\stackrel{+X}{→}$C
①若B为白色胶状不溶物,则A与C反应的离子方程式为Al3++3AlO2?+6H2O=4Al(OH)3↓.
②若向B溶液中滴加铁氰化钾溶液会产生特征蓝色沉淀,则A与C反应的离子方程式为Fe+2Fe3+=3Fe2+.
| 元素代号 | X | Y | Z | M | R |
| 原子半径/nm | 0.186 | 0.102 | 0.075 | 0.074 | 0.143 |
| 主要化合价 | +1 | +6-2 | +5-3 | -2 | +3 |
(2)X与Y按原子个数比1:1构成的物质的电子式为
 ;所含化学键类型离子键、共价键.
;所含化学键类型离子键、共价键.(3)X+,Y2?,M2?离子半径大小顺序为S2?>O2?>Na+.
(4)将YM2通入FeCl3溶液中的离子方程式2H2O+SO2+2Fe3+=2Fe2++SO42-+4H+.
(5)用Cu单质作阳极,石墨作阴极,X的最高价氧化物对应的水化物溶液作电解液进行电解,写出阳极的反应式Cu+2OH?-2e?=Cu(OH)2.
Ⅱ如图转化关系A$\stackrel{+X}{→}$B$\stackrel{+X}{→}$C
①若B为白色胶状不溶物,则A与C反应的离子方程式为Al3++3AlO2?+6H2O=4Al(OH)3↓.
②若向B溶液中滴加铁氰化钾溶液会产生特征蓝色沉淀,则A与C反应的离子方程式为Fe+2Fe3+=3Fe2+.
4.有A、B、C、D四种金属,当A、B组成原电池时,电子流动方向A→B;当A、D组成原电池时,A为正极;B与E构成原电池时,电极反应式为:E2++2e-=E,B-2e-=B2+则A、B、D、E金属性由强到弱的顺序为( )
| A. | A>B>E>D | B. | A>B>D>E | C. | D>A>B>E | D. | D>E>A>B |
 .
.