题目内容
14.下列有关化学用语表示正确的是( )| A. | ${\;}_{8}^{16}$O2-离子的结构示意图: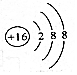 | |
| B. | 碳酸氢钠熔融时的电离方程式:NaHCO3?Na++HCO3- | |
| C. | 次氯酸的结构式:Cl-O-H | |
| D. | 过氧化氢的电子式: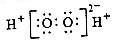 |
分析 A.O2-离子的质子数为8;
B.碳酸氢钠为强电解质,熔融时离子键断裂;
C.次氯酸中O最外层为6个电子,分别与Cl、H形成共价键;
D.过氧化氢为共价化合物.
解答 解:A.O2-离子的质子数为8,核外电子数为10,O2-离子的结构示意图为 ,故A错误;
,故A错误;
B.碳酸氢钠为强电解质,熔融时离子键断裂,则熔融时的电离方程式为NaHCO3═Na++HCO3-,故B错误;
C.次氯酸中O最外层为6个电子,分别与Cl、H形成共价键,则结构式为Cl-O-H,故C正确;
D.过氧化氢为共价化合物,过氧化氢的电子式为 ,故D错误;
,故D错误;
故选B.
点评 本题考查化学用语,为高频考点,把握结构示意图、电子式、结构式、电离方程式为解答的关键,侧重分析与应用能力的考查,注意化学用语的区别及规范使用,题目难度不大.

练习册系列答案
相关题目
4.有A、B、C、D四种金属,当A、B组成原电池时,电子流动方向A→B;当A、D组成原电池时,A为正极;B与E构成原电池时,电极反应式为:E2++2e-=E,B-2e-=B2+则A、B、D、E金属性由强到弱的顺序为( )
| A. | A>B>E>D | B. | A>B>D>E | C. | D>A>B>E | D. | D>E>A>B |
9.室温下,下列各组离子在指定溶液中,一定能大量共存的是( )
| A. | pH=1的溶液中:Na+、Fe2+、NO3-、SO42- | |
| B. | 水电离出的c(H+)=1×10-12mol•L-1的溶液中:K+、Al3+、Cl-、SO42- | |
| C. | 加入酚酞溶液显红色的溶液中:Na+、K+、HCO3-、Cl- | |
| D. | 无色溶液中:K+、NH4+、Cl-、NO3- |
19.下列有关实验叙述不正确的是( )
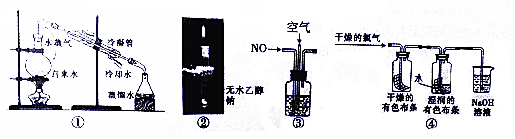

| A. | 图①用于除去自来水中的Fe3+、C1-等杂质离子 | |
| B. | 图②中直接点燃气体,证明钠与乙醇反应的气体产物是H2 | |
| C. | 图③在探究NO充分转化成HNO3的实验中,观察气泡速率控制通入气体体积比 | |
| D. | 图④用该实验可以证明Cl2体现漂白作用的原因 |
1.用NA表示阿伏加德罗常数的数值,下列判断正确的是( )
| A. | 1mo lCl2参加反应转移电子数一定为2NA | |
| B. | 一定条件下,足量铜与200g98%的浓硫敌充分反应,转移电子数为2NA | |
| C. | 300mL 2mol/L蔗糖溶液中所含蔗糖分子数为0.6NA | |
| D. | 标准状况下,22.4L氦气与22.4L氟气所含原子数均为2NA |
 钴及其化合物可作为一些化学合成的催化剂,亦用于油漆、颜料、玻璃、釉瓷及电极板等的制造.
钴及其化合物可作为一些化学合成的催化剂,亦用于油漆、颜料、玻璃、釉瓷及电极板等的制造.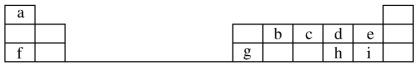
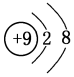 ,元素g的简单离子的结构示意图为
,元素g的简单离子的结构示意图为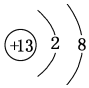 ,二者的离子半径大小顺序为F->Al3+.
,二者的离子半径大小顺序为F->Al3+.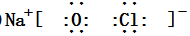 ,该化合物中所含的化学键类型为离子键、共价键.
,该化合物中所含的化学键类型为离子键、共价键.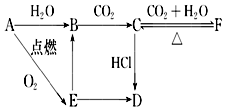 A、B、C、D、E、F六种含有相同元素的物质有如图变化关系,E是淡黄色粉末:
A、B、C、D、E、F六种含有相同元素的物质有如图变化关系,E是淡黄色粉末: