题目内容
2.以锌片和铜片为两极、稀硫酸为电解液组成原电池,当导线中通过2mo1电子时,下列说法正确的是( )| A. | 锌片溶解了1mol,铜片上析出1mol氢气 | |
| B. | 两极上溶解和析出的物质的质量相等 | |
| C. | 锌片溶解了1g,铜片上析出1g氢气 | |
| D. | 电解质溶液pH不变 |
分析 由铜、锌和稀硫酸组成的原电池,其中正极材料是铜,溶液中氢离子得到电子生成氢气,电极反应2H++2e-=H2↑,锌做负极失电子生成锌离子,电极反应为:Zn-2e-=Zn2+,电池反应的离子方程式为:Zn+2H+=Zn2++H2↑,当导线中通过2mo1电子时,生成1mol气体,溶解1molZn,以此来解答.
解答 解:电池反应的离子方程式为:Zn+2H+=Zn2++H2↑,当导线中通过2mo1电子时,生成1mol气体,溶解1molZn,
A.由上述分析可知,锌片溶解了1mol,铜片上析出1mol氢气,故A正确;
B.两极上溶解和析出的物质的质量分别为65g、2g,不相等,故B错误;
C.由选项B可知,锌片溶解了65g,铜片上析出2g氢气,故C错误;
D.氢离子浓度减小,pH增大,故D错误;
故选A.
点评 本题考查原电池及电极反应,为高频考点,把握发生的电极反应及物质的量的相关计算为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案
相关题目
12.下列气体中,比氧气与血红蛋白结合能力强,能引起中毒的是( )
| A. | N2 | B. | NO | C. | CH4 | D. | NH3 |
13.c(OH-)相同的氢氧化钠溶液和氨水,分别用蒸馏水稀释至原体积的m倍和n倍,若稀释后两溶液的c(OH-)仍相同,则m和n的关系是( )
| A. | m>n | B. | m=n | C. | m<n | D. | 不能确定 |
10.25℃某气态烃与氧气混合充入密闭容器中,点火爆炸后,恢复到25℃,此时容器内压强为开始时的一半,再经氢氧化钠溶液处理后,容器内几乎为真空,该烃的分子式为( )
| A. | C2H4 | B. | C2H6 | C. | C3H4 | D. | C3H6 |
9.由短周期元素组成的中学常见物质A、B、C、D、E、X存在如图转化关系(部分生成物和反应条件略去),下列推断不正确的是( )
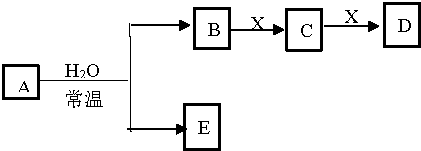

| A. | 若D是白色沉淀,D与A的摩尔质量相等,则X可能是铝盐 | |
| B. | 若X是Na2SO3,C是气体,则A可能是氯气,且D和E能发生反应 | |
| C. | 若D是CO,C能和E反应,则A是Na2O2,X的同素异形体只有3种 | |
| D. | 若A是单质,B和D的反应是,则E一定能还原Fe2O3 |
6.将mg铜粉和镁粉的混合物分成两等份,其中一份加入100mL的稀硝酸中并加热,固体和硝酸恰好完全反应,反应前后溶液体积变化忽略不计,反应产生NO、NO2(不考虑N2O4的影响)混合气体4.48L(标准状况下);将另一份在空气中充分加热至恒重,称得固体质量增加3.2g.下列有关说法中正确的是( )
| A. | 无法确定硝酸的浓度 | B. | n(NO):n(NO2)=1:1 | ||
| C. | 4.8<m<12.8 | D. | 反应后c(NO${\;}_{3}^{-}$)=4mol/L |
