题目内容
已知在NaClO溶液中通入少量的CO2,其反应方程式为:
NaClO+H2O+CO2=NaHCO3+HClO ①
漂白粉的漂白原理是Ca(ClO)2+H2O+CO2=CaCO3↓+2HC10 ②
试回答:
(1)HClO、H2CO3、HCO3-酸性由强到弱的顺序是 .
(2)第二个反应能进行的原因是 (请用方程式和必要的文字加以说明).
(3)相同pH的NaClO、NaHCO3、Na2CO3和NaOH溶液,其物质的量浓度由大到小的顺序为 ,加水稀释相同倍数后,pH变化最大的是 .
(4)在同体积同浓度的NaClO和NaHCO3溶液中,离子数目较多的是 (填“NaC10溶 液”或“NaHC03溶液”).
NaClO+H2O+CO2=NaHCO3+HClO ①
漂白粉的漂白原理是Ca(ClO)2+H2O+CO2=CaCO3↓+2HC10 ②
试回答:
(1)HClO、H2CO3、HCO3-酸性由强到弱的顺序是
(2)第二个反应能进行的原因是
(3)相同pH的NaClO、NaHCO3、Na2CO3和NaOH溶液,其物质的量浓度由大到小的顺序为
(4)在同体积同浓度的NaClO和NaHCO3溶液中,离子数目较多的是
考点:弱电解质在水溶液中的电离平衡,盐类水解的应用,钠的重要化合物
专题:
分析:(1)根据强酸制备弱酸的特点比较酸性强弱;
(2)二氧化碳通入漂白粉中首先发生H2O+CO2+ClO-=HCO3-+HClO,存在HCO3- H++CO32-,电离出的CO32-和Ca2+结合生成了CaCO3沉淀,促进HCO3-的电离,平衡正向移动;
H++CO32-,电离出的CO32-和Ca2+结合生成了CaCO3沉淀,促进HCO3-的电离,平衡正向移动;
(3)NaClO、NaHCO3、Na2CO3水解呈碱性,pH相等时,NaOH浓度最小,水解程度越大,对应的盐溶液浓度越小,稀释时,促进盐类的水解;
(4)根据水解程度结合电荷守恒判断.
(2)二氧化碳通入漂白粉中首先发生H2O+CO2+ClO-=HCO3-+HClO,存在HCO3-
 H++CO32-,电离出的CO32-和Ca2+结合生成了CaCO3沉淀,促进HCO3-的电离,平衡正向移动;
H++CO32-,电离出的CO32-和Ca2+结合生成了CaCO3沉淀,促进HCO3-的电离,平衡正向移动;(3)NaClO、NaHCO3、Na2CO3水解呈碱性,pH相等时,NaOH浓度最小,水解程度越大,对应的盐溶液浓度越小,稀释时,促进盐类的水解;
(4)根据水解程度结合电荷守恒判断.
解答:
解:(1)由反应①可知酸性H2CO3>HClO,因生成NaHCO而不生成二氧化碳气体,可说明酸性HClO>HCO3-,故答案为:H2CO3>HClO>HCO3-;
(2)二氧化碳通入漂白粉中首先发生H2O+CO2+ClO-=HCO3-+HClO,存在HCO3- H++CO32-,电离出的CO32-和Ca2+结合生成了CaCO3沉淀,减少了CO32-离子浓度,促使HCO3-的电离平衡向右移动,增大了H+的浓度,生成HClO,
H++CO32-,电离出的CO32-和Ca2+结合生成了CaCO3沉淀,减少了CO32-离子浓度,促使HCO3-的电离平衡向右移动,增大了H+的浓度,生成HClO,
故答案为:在反应②中存在HCO3- H++CO32-,电离出的CO32-和Ca2+结合生成了CaCO3沉淀,减少了CO32-离子浓度,促使HCO3-的电离平衡向右移动,增大了H+的浓度,生成HClO;
H++CO32-,电离出的CO32-和Ca2+结合生成了CaCO3沉淀,减少了CO32-离子浓度,促使HCO3-的电离平衡向右移动,增大了H+的浓度,生成HClO;
(3)NaClO、NaHCO3、Na2CO3水解呈碱性,pH相等时,NaOH浓度最小,水解程度越大,对应的盐溶液浓度越小,则NaHCO3>NaClO>Na2CO3>NaOH,
稀释时,促进盐类的水解,pH变化最大的为NaOH溶液,
故答案为:NaHCO3>NaClO>Na2CO3>NaOH;NaOH溶液;
(4)根据电荷守恒,2c(CO32-)+c(HCO3-)+c(OH-)=c(Na+)+c(H+),c(ClO-)+c(OH-)=c(Na+)+c(H+),即离子总数是n(Na+ )+n(H+)的2倍,而NaClO的水解程度大,即NaClO溶液中的c(OH-)大,c(H+)小,c(Na+)相同,所以NaHCO3中离子浓度大,
故答案为:NaHCO3溶液.
(2)二氧化碳通入漂白粉中首先发生H2O+CO2+ClO-=HCO3-+HClO,存在HCO3-
 H++CO32-,电离出的CO32-和Ca2+结合生成了CaCO3沉淀,减少了CO32-离子浓度,促使HCO3-的电离平衡向右移动,增大了H+的浓度,生成HClO,
H++CO32-,电离出的CO32-和Ca2+结合生成了CaCO3沉淀,减少了CO32-离子浓度,促使HCO3-的电离平衡向右移动,增大了H+的浓度,生成HClO,故答案为:在反应②中存在HCO3-
 H++CO32-,电离出的CO32-和Ca2+结合生成了CaCO3沉淀,减少了CO32-离子浓度,促使HCO3-的电离平衡向右移动,增大了H+的浓度,生成HClO;
H++CO32-,电离出的CO32-和Ca2+结合生成了CaCO3沉淀,减少了CO32-离子浓度,促使HCO3-的电离平衡向右移动,增大了H+的浓度,生成HClO;(3)NaClO、NaHCO3、Na2CO3水解呈碱性,pH相等时,NaOH浓度最小,水解程度越大,对应的盐溶液浓度越小,则NaHCO3>NaClO>Na2CO3>NaOH,
稀释时,促进盐类的水解,pH变化最大的为NaOH溶液,
故答案为:NaHCO3>NaClO>Na2CO3>NaOH;NaOH溶液;
(4)根据电荷守恒,2c(CO32-)+c(HCO3-)+c(OH-)=c(Na+)+c(H+),c(ClO-)+c(OH-)=c(Na+)+c(H+),即离子总数是n(Na+ )+n(H+)的2倍,而NaClO的水解程度大,即NaClO溶液中的c(OH-)大,c(H+)小,c(Na+)相同,所以NaHCO3中离子浓度大,
故答案为:NaHCO3溶液.
点评:本题考查盐类水解的应用及弱电解质的电离,为高频考点,侧重于学生的分析能力和计算能力的考查,明确盐类水解规律及酸性强弱的关系,题目难度中等.

练习册系列答案
 名校通行证有效作业系列答案
名校通行证有效作业系列答案
相关题目
双酚A是食品、饮料包装和奶瓶等塑料制品的添加剂,能导致人体内分泌失调,对儿童的健康危害更大.下列有关双酚A的叙述不正确的是( )


| A、双酚A的相对分子质量为228 |
| B、双酚A的核磁共振氢谱显示氢原子数之比为1:2:2:3 |
| C、反应①中,1mol双酚A最多消耗2mol Br2 |
| D、反应②的产物只有一种官能团 |
火法炼铜首先要焙烧黄铜矿(主要成分为CuFeS2,其中Cu、Fe均为+2价),其反应为:
2CuFeS2+O2
Cu2S+2FeS+SO2关于此反应,下列说法不正确的是( )
2CuFeS2+O2
| ||
| A、CuFeS2中只有硫元素被氧化 |
| B、每生成1mol SO2,反应中转移6mol电子 |
| C、该反应中有两种物质作氧化剂 |
| D、CuFeS2中被氧化和被还原的原子数之比为2:1 |
下列有关有机化合物的结构和性质的叙述,正确的是( )
| A、苯的硝化、丙烯使高锰酸钾酸性溶液褪色的反应都属于取代反应 |
| B、C8H10含苯环的烃同分异构体有3种 |
| C、乙烯、苯、乙烷分子中的所有原子都在同一平面上 |
D、莽草酸( )能使溴的四氯化碳溶液褪色 )能使溴的四氯化碳溶液褪色 |
分离汽油和氯化钠溶液的混合液体,应用下列哪种分离方法( )
| A、蒸发 | B、过滤 | C、萃取 | D、分液 |
下列说法正确的是( )
| A、向1 mo1?L-l CH3COOH溶液中加入少量CH3COONa固体,由于CH3COONa水解显碱性,所以溶液的pH升高 | ||||||||||
B、25℃时,将a mo1?L-l氨水与0.01 moI?L-1盐酸等体积混合,反应完全时溶液中Kb=
| ||||||||||
C、根据下表数据可以计算出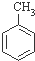 (g)+3H2(g)→ (g)+3H2(g)→ (g)的焓变 (g)的焓变
| ||||||||||
| D、已知298K时,MgCO3的Ksp=6.82×10-6,溶液中c(Mg2+)=0.0001 mol?L-1,c(CO32-)=0.0001 mol?L-1,此时Mg2+和CO32-不能共存 |
鉴别甲烷、一氧化碳和氢气三种无色气体的方法,是将它们分别( )
| A、先后通入溴水和澄清的石灰水 |
| B、点燃后罩上涂有澄清石灰水的烧杯 |
| C、点燃后罩上涂有澄清石灰水的烧杯,通入溴水 |
| D、点燃,先后罩上干燥的冷烧杯和涂有澄清石灰水的烧杯 |

