题目内容
10.已知A、B、C、D和E 5种分子所含原子数目依次为1、2、3、4和6,且都含有18个电子.又知B、C和D是由两种元素的原子组成.请回答:(1)组成A分子的原子的核外电子排布式是1s22s22p63s23p6;
(2)B的分子式是HCl;C分子的立体结构呈V型;
(3)若向D的稀溶液中加入少量二氧化锰,有无色气体生成.则D的电子式是
 ;
;(4)若将1mol E在氧气中完全燃烧的产物为CO2和H2O,且E可与Na反应放出H2,则E的结构简式是CH3OH.
分析 已知A、B、C、D和E五种分子所含原子的数目依次为1、2、3、4和6,且都含有18个电子,则A是Ar,又知B、C和D是由两种元素的原子组成,所以B是HCl,C是H2S,四原子分子D为PH3或H2O2,若向D的稀溶液中加入少量二氧化锰,有无色气体生成,符合题意的D为H2O2,
(1)根据构造原理写出其核外电子排布式;
(2)根据上面的分析可知B和C的分子式;根据价层电子对互斥理论确定分子的立体结构;
(3)双氧水在二氧化锰作催化剂的条件下分解生成水和氧气,从而书写双氧水的电子式;
(4)根据生成物及物质的量之间的关系式确定E的分子式.
解答 解:已知A、B、C、D和E五种分子所含原子的数目依次为1、2、3、4和6,且都含有18个电子,则A是Ar,又知B、C和D是由两种元素的原子组成,所以B是HCl,C是H2S,四原子分子D为PH3或H2O2,若向D的稀溶液中加入少量二氧化锰,有无色气体生成,符合题意的D为H2O2,
(1)A是氩,其核外电子排布式为1s22s22p63s23p6,
故答案为:1s22s22p63s23p6;
(2)通过以上分析知,B和C的分子式分别是HCl、H2S,C分子中硫原子的价层电子对=2+$\frac{1}{2}$×(6-2×1)=4,所以其空间构型是V型,
故答案为:HCl;V型;
(3)若向D的稀溶液中加入少量二氧化锰,有无色气体生成,则D是H2O2,双氧水的电子式为 ,故答案为:
,故答案为: ;
;
(4)若将1mol E在氧气中完全燃烧,只生成1mol CO2和2mol H2O,说明E中含有碳氢元素,且碳氢个数比为1:4,E中含有6个原子,所以还含有一个氧原子,所以E的分子式为CH4O,且E可与Na反应放出H2,所以是醇,则结构简式是CH3OH
故答案为:CH3OH.
点评 本题考查物质结构及性质,正确推断物质是解本题关键,核外电子排布式的书写、分子构型的判断、电子式的书写等是高考热点,应重点掌握.

| 化学式 | 电离常数 |
| HF | Ki=3.5×10-4 |
| H2CO3 | Ki1=4.4×10-7 |
| Ki2=4.7×10-11 | |
| HClO | Ki=3.2×10-8 |
| A. | 同温同浓度下,溶液的pH:NaF>NaClO>Na2CO3 | |
| B. | 结合H+的能力:ClO-<HCO3-<F- | |
| C. | 次氯酸钠溶液中通少量二氧化碳的离子方程式:ClO-+CO2+H2O═HCO3-+HClO | |
| D. | 碳酸钠溶液中加入少量氢氟酸的离子方程式:CO32-+2HF═2F-+H2O+CO2↑ |
| A. | 18O、31P、119Sn | B. | 27Al、19F、12C | ||
| C. | 7N、15P、33As、51Sb、83Bi | D. | 只有一个电子层的原子 |
| A. | 按系统命名法 的名称为:4,7-二甲基-3-乙基壬烷 的名称为:4,7-二甲基-3-乙基壬烷 | |
| B. | 等物质的量的Na、NaOH、NaHCO3分别与足量的有机物( )充分反应,消耗该有机物的物质的量之比为2:3:6(已知酸性大小关系 )充分反应,消耗该有机物的物质的量之比为2:3:6(已知酸性大小关系 >H2CO3> >H2CO3> ) ) | |
| C. | 乙醇和二甲醚互为同分异构体,CH3-CH=CH-CH3与C3H6一定互为同系物 | |
| D. | 蛋白质、油脂、糖均能在一定条件下水解 |
| A. | 用酸性高锰酸钾溶液区别乙烷和乙烯 | |
| B. | 用BaCl2除去NaOH 溶液中混有的少量Na2SO4 | |
| C. | 用KSCN溶液检验溶液中含有的Fe2+ | |
| D. | 用溶解、过滤的方法分离CaCl2和NaCl固体混合物 |
 .
.

 .
.
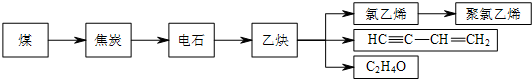
 ,随意丢弃聚氯乙烯制品会造成白色污染.
,随意丢弃聚氯乙烯制品会造成白色污染.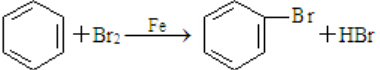 ,该反应中反应物溴应该选用液溴(填“溴水”或“液溴”).
,该反应中反应物溴应该选用液溴(填“溴水”或“液溴”).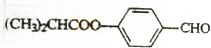 E的合成路线如下:
E的合成路线如下: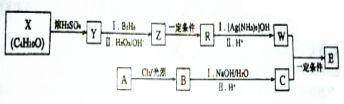
 .X→Y的反应类型是消去反应.
.X→Y的反应类型是消去反应.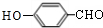 $?_{△}^{浓硫酸}$
$?_{△}^{浓硫酸}$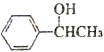 )为原料合成苯乙醛,设计合成路线:
)为原料合成苯乙醛,设计合成路线: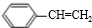 $\frac{Ⅰ.{B}_{2}{H}_{6}}{Ⅱ.{H}_{2}{O}_{2}/OH}$
$\frac{Ⅰ.{B}_{2}{H}_{6}}{Ⅱ.{H}_{2}{O}_{2}/OH}$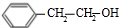 $\stackrel{Cu/△}{→}$
$\stackrel{Cu/△}{→}$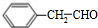 .
.