题目内容
1.足量金属镁与一定量浓硝酸反应,得到硝酸镁溶液和NO2、N2O4、NO的混合气体,这些气体与2.52LO2(标准状况)混合后通入水中.所有气体完全被水吸收生成硝酸.若向所得硝酸镁溶液中加入2.5mol/LNaOH溶液至Mg2+恰好完全沉淀,则消耗NaOH溶液的体积是( )| A. | 45mL | B. | 180mL | C. | 90mL | D. | 135mL |
分析 向所得硝酸镁溶液中加入NaOH溶液至Mg2+恰好完全沉淀,沉淀为Mg(OH)2,由电荷守恒可知,Mg提供电子物质的量等于Mg(OH)2中氢氧根的物质的量,生成NO2、N2O4、NO 的混合气体与2.52L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸,纵观整个过程,由电子转移守恒,可知Mg提供电子等于氧气获得的电子,据此计算n(NaOH),进而计算消耗氢氧化钠溶液体积.
解答 解:生成NO2、N2O4、NO 的混合气体与2.52L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸,纵观整个过程,由电子转移守恒,可知Mg提供电子等于氧气获得的电子,即Mg提供电子为:$\frac{2.52L}{22.4L/mol}$×4=0.45mol,
向所得硝酸镁溶液中加入NaOH溶液至Mg2+恰好完全沉淀,沉淀为Mg(OH)2,由电荷守恒可知,Mg提供电子物质的量等于Mg(OH)2中氢氧根的物质的量,故n(NaOH)=0.45mol,故消耗氢氧化钠溶液体积为$\frac{0.45mol}{2.5mol/L}$=0.18L=180mL,
故选B.
点评 本题考查混合物计算,难度中等,侧重考查学生的分析思维能力与解题方法技巧,注意利用守恒法进行解答.

练习册系列答案
相关题目
11.在标准状况下,将a L NH3完全溶于水得到V mL氨水,溶液的密度为ρ g•cm-3,溶质的质量分数为ω,溶质的物质的量浓度为C mol/L.下列叙述中正确的是( )
| A. | ω=$\frac{35a}{22.4Vρ}$×100% | |
| B. | C=$\frac{1000a}{22.4V}$mol/L | |
| C. | 可用装置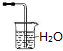 吸收氨气 吸收氨气 | |
| D. | 上述溶液中再加入VmL水,所得溶液的质量分数大于0.5ω |
12.铁钉和碳棒用导线连接,浸入稀NaCl溶液中,正极发生的反应是( )
| A. | 2H++2e-═H2↑ | B. | 2H2O+O2+4e-═4OH- | ||
| C. | Fe-2e-═Fe2+ | D. | 4OH--4e-═2H2O+O2↑ |
9.下列关于物质用途的说法中,不正确的是( )
| A. | Fe2O3可以做油漆的颜料 | B. | Al2O3可用作耐火材料 | ||
| C. | 铝合金比纯铝的熔点更高 | D. | 赤铁矿可用作炼铁的原料 |
16.将SO2通入BaCl2溶液至饱和,未见沉淀,继续通入某气体仍无沉淀,则该气体可能是( )
| A. | Cl2 | B. | NH3 | C. | NO2 | D. | CO2 |
6.用NA表示阿伏伽德罗常数,下列叙述正确的是( )
| A. | 2.7g铝与足量的NaOH溶液反应转移的电子数目为0.2NA | |
| B. | 1L0.5mol/L的(NH4)2SO4溶液中含有的NH4+数目为NA | |
| C. | 2mol SO2和1molO2在一定条件下充分反应后,所得混合气体的分子数大于2NA | |
| D. | 2.24L N2和NH3混合气体中原子间含有的共用电子对数目为0.3NA |
13.下列各组中的反应,属于同一反应类型的是( )
| A. | 1-丙醇制丙烯;丙烯与溴水反应制1,2-二溴丙烷 | |
| B. | 溴乙烷水解制丙醇;丙烯与水反应制丙醇 | |
| C. | 甲苯硝化制对硝基甲苯;甲苯氧化制苯甲酸 | |
| D. | 乙酸和乙醇制乙酸乙酯;苯甲酸乙酯水解制苯甲酸和乙醇 |
20.实验报告中,以下数据合理的是( )
| A. | 用碱式滴定管量取25.03mLH2SO4溶液 | |
| B. | 用50mL量筒量取21.48mL稀硫酸 | |
| C. | 用pH试纸测定HNO3溶液的pH=3.7 | |
| D. | 用托盘天平称取11.7gNaCl |