题目内容
下列说法中,正确的是( )
| A、0.1mol/L的醋酸溶液加水稀释,c(H+)、c(OH-)同比例减小 |
| B、体积相同、pH相同的NH4Cl溶液、盐酸,完全溶解少量且等量的镁粉,前者用时少 |
| C、将n mol H2(g)、n mol I2(g)和2n mol H2(g)、2n mol I2(g)分别充入两个恒温恒容的容器中,平衡时H2的转化率前者小于后者 |
| D、室温下,某溶液中由水电离出的c(H+)=10-a mol/L,a<7时,溶液的pH一定为14-a |
考点:弱电解质在水溶液中的电离平衡,化学平衡的影响因素
专题:基本概念与基本理论
分析:A.加水稀释促进醋酸电离,溶液中c(H+)减小、c(OH-)增大;
B.氢离子浓度越大其反应速率越快,消耗相同质量的镁粉时消耗时间越短;
C.H2(g)+I2(g)?2HI(g),该反应反应前后气体计量数之和不变,压强不影响其转化率;
D.室温下,某溶液中由水电离出的c(H+)=10-a mol/L>10-7 mol/L,促进水电离,说明溶液中的溶质为含有弱离子的盐.
B.氢离子浓度越大其反应速率越快,消耗相同质量的镁粉时消耗时间越短;
C.H2(g)+I2(g)?2HI(g),该反应反应前后气体计量数之和不变,压强不影响其转化率;
D.室温下,某溶液中由水电离出的c(H+)=10-a mol/L>10-7 mol/L,促进水电离,说明溶液中的溶质为含有弱离子的盐.
解答:
解:A.加水稀释促进醋酸电离,醋酸电离增大程度小于溶液体积增大程度,所以溶液中c(H+)减小,温度不变,水的离子积醋酸不变,则c(OH-)增大,故A错误;
B.反应过程中促进铵根离子水解,所以反应过程中氯化铵中氢离子浓度大于稀盐酸,氢离子浓度越大其反应速率越快,消耗相同质量的镁粉时消耗时间越短,则前者用时少,故B正确;
C.H2(g)+I2(g)?2HI(g),该反应反应前后气体计量数之和不变,压强不影响其转化率,所以二者的转化率相等,故C错误;
D.室温下,某溶液中由水电离出的c(H+)=10-a mol/L>10-7 mol/L,促进水电离,说明溶液中的溶质为含有弱离子的盐,溶液的pH为a或14-a,故D错误;
故选B.
B.反应过程中促进铵根离子水解,所以反应过程中氯化铵中氢离子浓度大于稀盐酸,氢离子浓度越大其反应速率越快,消耗相同质量的镁粉时消耗时间越短,则前者用时少,故B正确;
C.H2(g)+I2(g)?2HI(g),该反应反应前后气体计量数之和不变,压强不影响其转化率,所以二者的转化率相等,故C错误;
D.室温下,某溶液中由水电离出的c(H+)=10-a mol/L>10-7 mol/L,促进水电离,说明溶液中的溶质为含有弱离子的盐,溶液的pH为a或14-a,故D错误;
故选B.
点评:本题考查了弱电解质的电离、盐类水解、化学平衡的有关计算等知识点,B中反应速率只与离子浓度有关,注意C中反应特点,这些都是易错点.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
1L丙烷与xLO2混合点燃,丙烷充分反应后,生成的混合气体的体积为aL(气体体积均在120℃,101kPa时测定).将aL混合气体通过足量的碱石灰后,测得剩余气体的体积为bL.若a-b=6,则x的值为( )
| A、4 | B、4.5 | C、5 | D、5.5 |
在下列物质:①K2SO4、②甲醛、③MgSO4、④NH4Cl、⑤KOH、⑥Hg(NO3)2中,能使蛋白质变性的是( )
| A、②④⑥ | B、①③⑤ |
| C、②③⑥ | D、②⑤⑥ |
把100mL 2mol/L的H2SO4跟过量锌粉反应,在一定温度下,为了减缓反应速率而不影响生成H2的总量,可在反应物中加入适量的( )
| A、硫酸铜溶液 |
| B、硝酸钠溶液 |
| C、醋酸钠溶液 |
| D、氢氧化钠溶液 |
工业上用含Fe2O3杂质的铝土矿为原料冶炼铝的工艺流程如下:下列叙述正确的是( )
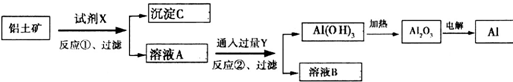

| A、反应①中试剂X是氢氧化钠溶液 |
| B、试剂Y是HCl,它与[Al(OH)4]-反应生成氢氧化铝 |
| C、图中所示转化反应中包含2个氧化还原反应 |
| D、将X与Y试剂进行对换,最终可以达到相同结果 |
用于呼吸用具上和潜水艇中作为氧气的来源的物质是( )
| A、Na2O2 |
| B、NaHCO3 |
| C、SO3(固) |
| D、KMnO4 |
下列说法正确的是( )
| A、向NaOH溶液中慢慢滴加FeCl3饱和溶液,可制得Fe(OH)3胶体 |
| B、胶体与其他分散系的本质区别是胶体能发生丁达尔效应 |
| C、Fe(OH)3胶体中的分散质为氢氧化铁分子 |
| D、向沸水中滴加FeCl3饱和溶液,加热至溶液变为红褐色,停止加热,制得氢氧化铁胶体 |
下列判断不正确的是( )
| A、沸点:NH3>PH3>AsH3 |
| B、熔点:Si3N4>NaCl>SiI4 |
| C、酸性:HClO4>H2SO4>H3PO4 |
| D、碱性:NaOH>Mg(OH)2>Al(OH)3 |
下列化学方程式不正确的是( )
A、乙醇与浓氢溴酸反应CH3CH2OH+HBr
| |||
B、溴乙烷与氢氧化钠溶液共热CH3CH2Br+NaOH
| |||
C、苯酚钠中通入二氧化碳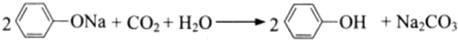 | |||
D、蔗糖在稀硫酸作用下水解C12H22011(蔗糖)+H2O
|