题目内容
工业上用含Fe2O3杂质的铝土矿为原料冶炼铝的工艺流程如下:下列叙述正确的是( )
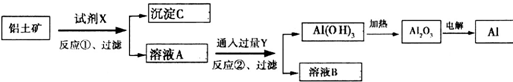

| A、反应①中试剂X是氢氧化钠溶液 |
| B、试剂Y是HCl,它与[Al(OH)4]-反应生成氢氧化铝 |
| C、图中所示转化反应中包含2个氧化还原反应 |
| D、将X与Y试剂进行对换,最终可以达到相同结果 |
考点:物质分离和提纯的方法和基本操作综合应用
专题:实验设计题
分析:综合分析工艺流程图可知,试剂X是氢氧化钠溶液,Al2O3溶于氢氧化钠溶液得到NaAlO2溶液,Fe2O3与氢氧化钠溶液不反应,所以反应①过滤后所得溶液A为NaAlO2溶液,沉淀C为Fe2O3;Y为CO2,向NaAlO2溶液中通入过量CO2的化学方程式为NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3,溶液B为NaHCO3,电解熔融Al2O3属于氧化还原反应,以此解答该题.
解答:
解:A.分离氧化铝和氧化铁,只能用氢氧化钠溶液,不可能用盐酸,因氧化铝与氢氧化钠反应,氧化铁不反应,但二者都可与盐酸反应,故A正确;
B.如试剂Y是HCl,过量HCl与[Al(OH)4]-反应生成氯化铝,不可能得到氢氧化铝,故B错误;
C.只有电解熔融Al2O3属于氧化还原反应,故错误;
D.因二氧化碳与氧化铁、氧化铝都不反应,则将X与Y试剂进行对换,不能对物质进行分离,故D错误.
故选A.
B.如试剂Y是HCl,过量HCl与[Al(OH)4]-反应生成氯化铝,不可能得到氢氧化铝,故B错误;
C.只有电解熔融Al2O3属于氧化还原反应,故错误;
D.因二氧化碳与氧化铁、氧化铝都不反应,则将X与Y试剂进行对换,不能对物质进行分离,故D错误.
故选A.
点评:本题以铁、铝化合物的性质为载体综合考查工业冶炼铝等知识,侧重于考查学生分析和解决问题的能力,综合性强,为高考常见题型,注意把握制备原理和反应的流程,难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列实验装置设计正确、且能达到目的是( )
A、 从氯化铁溶液中直接蒸发结晶获得无水氯化铁 |
B、 检验电解饱和食盐水的产物Cl2 |
C、 配制一定的物质的量浓度的稀硫酸溶液 |
D、 除去Cl2中含有的少量HCl |
设阿伏伽德罗常数的值为NA,下列说法中正确的是( )
| A、1mo苯中含有的C═C数为3NA |
| B、2.8g乙烯和丙烯的混合气体中所含碳原子数为0.2NA |
| C、0.1molC5H12中含有的C-C键数为0.5NA |
| D、标准状况下,2.24LCCl4含有的分子数为0.1NA |
某同学将金属钠露置于空气中,观察到下列现象:银白色→变灰暗→变白色→出现液滴→白色固体.其变质过程中不可能产生的物质是( )
| A、Na2O |
| B、NaOH |
| C、Na2CO3 |
| D、NaHCO3 |
逻辑推理是化学学习中常用的一种思维方法,以下推理中正确的是( )
| A、化合物都是由不同元素组成的,不同元素组成的物质一定是化合物 |
| B、金属镁排在金属活动性顺序表中氢元素的前面,所以其与稀硝酸反应一定放出氢气 |
| C、常温下,碱的水溶液的pH>7,则pH>7的水溶液一定是碱的水溶液 |
| D、氧化物中都含有氧元素,含氧元素的化合物不一定是氧化物 |
下列说法中,正确的是( )
| A、0.1mol/L的醋酸溶液加水稀释,c(H+)、c(OH-)同比例减小 |
| B、体积相同、pH相同的NH4Cl溶液、盐酸,完全溶解少量且等量的镁粉,前者用时少 |
| C、将n mol H2(g)、n mol I2(g)和2n mol H2(g)、2n mol I2(g)分别充入两个恒温恒容的容器中,平衡时H2的转化率前者小于后者 |
| D、室温下,某溶液中由水电离出的c(H+)=10-a mol/L,a<7时,溶液的pH一定为14-a |
有关反应:4NH3(g)+5O2 (g)=4NO(g)+6H2O(g)△H=-905kJ/mol 的描述不正确的是( )
| A、生成物的总能量小于反应物的总能量 |
| B、该反应为吸热反应 |
| C、活化分子间的碰撞不一定是有效碰撞 |
| D、该反应中每4 mol NH3(g)被氧化,放出905 kJ热量 |
现行的长式周期表,由左到右为18个纵行,碱金属族为第1纵行,稀有气体为第18纵行,按这个规定,下列说法中不正确的是( )
| A、第10纵行中肯定没有非金属元素 |
| B、第3纵行中元素种类繁多 |
| C、计算机芯片的组成元素位于第15纵行 |
| D、第1纵行元素单质从上到下熔点逐渐降低,第17纵行元素单质从上到下熔点逐渐升高 |
以下关于金属钠的叙述中不正确的是( )
| A、金属钠可保存在煤油中 |
| B、金属钠可将铁从其溶液中置换出来 |
| C、钠投入水中立即熔化成小球,说明钠的熔点低,且钠与水反应为放热反应 |
| D、钠在空气中能缓慢氧化而变暗 |