题目内容
15.S2C12在工业上用作橡胶硫化剂.实验室利用下列装置(部分夹持仪器己略去),将干燥纯净的Cl2通入CS2液体中制备S2C12:CS2+3C12$\frac{\underline{\;95℃~100℃\;}}{\;}$CCl4+S2C12.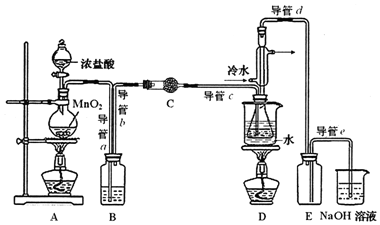
已知:
| 物质 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | 溶解性 |
| S | 113 | 444 | 1.96 | 不溶于水 |
| S2Cl2 | -76 | 138 | 1.75 | 与水反应 |
| CS2 | -109 | 47 | 1.26 | 不溶于水 |
| CCl4 | -23 | 77 | 1.59 | 不溶于水 |
①通入C12 ②熄灭装置A中酒精灯 ③通入冷水④关闭冷水 ⑤加热装置D ⑥熄灭装置D中酒精灯
(2)为获得平缓稳定的Cl2气流,A装置的操作是控制分液漏斗下端的活塞,使浓盐酸匀速滴下.
(3)装置C中盛有的试剂是无水CaCl2(或P2O5);装置B中盛的试剂是饱和食盐水.
(4)装置D中冷凝管的作用是导气、冷凝回流;装置E的作用是防倒吸
(5)实验过程中,若缺少C装置,则产品浑浊不清并产生2种酸性气体,写出其反应的化学方程式2S2Cl2+2H2O═3S↓+SO2↑+4HCl↑.
分析 制取原理是:显示二氧化锰和浓盐酸之间反应得到氯气,但是氯气中混有HCl和水,应该先用饱和食盐水除去HCl,再用无水CaCl2(或P2O5)干燥氯气,让氯气和二硫化碳在一定温度下发生反应:CS2+3C12$\stackrel{95℃~100℃}{→}$CCl4+S2C12,为了使CS2平稳汽化,避免产物S2Cl2汽化,采用热水浴加热的方法,根据S2Cl2的熔沸点数据,采用冷凝回流的办法将之收集即可,实验中用E装置作安全瓶,可以防倒吸,氯气要进行尾气处理,可以用氢氧化钠来吸收,据此答题.
解答 解:(1)该实验结束时先熄灭装置D中酒精灯,再熄灭装置A中酒精灯;
故答案为:⑥;②;
(2)根据上面的分析可知,为获得平缓稳定的Cl2气流,A装置的操作是控制分液漏斗下端的活塞,使浓盐酸匀速滴下;
故答案为:控制分液漏斗下端的活塞,使浓盐酸匀速滴下;
(3)装置C中盛有的试剂是无水CaCl2(或P2O5)干燥氯气,装置B中试剂为 饱和食盐水,吸收氯气中的氯化氢气体;
故答案为:无水CaCl2(或P2O5);饱和食盐水;
(4)装置D中冷凝管的作用是导气、冷凝回流,E装置作安全瓶,可以防倒吸;
故答案为:导气、冷凝回流;防倒吸;
(5)实验过程中,若缺少C装置,则装置中有水,S2Cl2会发生水解,产品中有硫产生而浑浊不清,并产生2种酸性气体为二氧化硫和氯化氢,其反应的化学方程式为2S2Cl2+2H2O═3S↓+SO2↑+4HCl↑,
故答案为:2S2Cl2+2H2O═3S↓+SO2↑+4HCl↑.
点评 本题考查了物质的制备,杂质气体除杂的装置选择和试剂选择,题干信息的应用分析,化学方程式书写方法,混合物分离的方法判断,题目难度中等.

练习册系列答案
相关题目
5.硫代硫酸钠与稀硫酸反应的方程式为:Na2S2O3+H2SO4═Na2SO4+SO2↑+S↓+H2O某学习小组为研究反应物浓度和温度对该反应速率的影响,设计以下3组实验下列说法不正确的是( )
| 实验序号 | 反应温度/℃ | Na2S2O3溶液 | 稀H2SO4 | H2O | ||
| V/mL | c/(mol•L-1) | V/mL | c/(mol•L-1) | V/mL | ||
| Ⅰ | 25 | 5 | 0.2 | 10 | 0.1 | x |
| Ⅱ | 25 | 10 | 0.1 | 10 | 0.2 | 5 |
| Ⅲ | 35 | 10 | 0.1 | 5 | y | 10 |
| A. | 该反应所需的仪器有:量筒、温度计、秒表、烧杯 | |
| B. | 通过记录产生淡黄色沉淀所需的时间可以比较反应的快慢 | |
| C. | 比实验 II、III研究温度对该反应速率的影响,则y=0.2 | |
| D. | 对比实验 I、II研究C(H+)对该反应速率的影响,则x=10 |
6.如图是部分短周期元素原子半径与原子序数的关系图,下列说法正确的是( )

| A. | Y、Q两种元素的气态氢化物及其最高价氧化物的水化物均为强酸 | |
| B. | 最高价氧化物对应水化物的碱性:Z<M | |
| C. | 气态氢化物的稳定性:R>Q | |
| D. | 简单离子的半径:X>Z>M |
3.利用锌锰干电池内的黑色固体水浸后的碳包滤渣(含MnO2、C、Hg2+等)制取MnSO4•H2O 的实验流程如图:

已知:25℃时,几种硫化物的溶度积常数如表:
25℃时,部分金属阳离子以氢氧化物形式沉淀时溶液的pH如表所示:
(1)上述流程中,蒸发实验操作时用到的硅酸盐材质的仪器有蒸发皿、玻璃棒、酒精灯.
(2)在加热条件下“浸取”,其原因是加快浸取时的反应速率;浸取时生成MnSO4和Fe2(SO4)3的化学方程式为9MnO2+2FeS+10H2SO4=9MnSO4+Fe2(SO4)3+10H2O.
(3)滤渣I的成分为MnO2、C和HgS(填化学式);若浸取反应在25℃时进行,FeS足量,则充分浸取后溶液中的$\frac{c(H{g}_{2}^{+})}{C(F{e}_{2}^{+})}$=4.4×10-37(填数值).
(4)“氧化”时的离子方程式为2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O;氧化时可用H2O2代替MnO2,H2O2的电子式为 .
.
(5)中和时,应该调节溶液pH的范围到3.7≤pH<8.3.

已知:25℃时,几种硫化物的溶度积常数如表:
| 物质 | FeS | MnS | HgS |
| 溶度积 | 5.0×l0-18 | 4.6×l0-14 | 2.2×l0-54 |
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 |
| 开始沉淀的pH | 2.7 | 7.6 | 8.3 |
| 完全沉淀的pH | 3.7 | 9.7 | 9.8 |
(2)在加热条件下“浸取”,其原因是加快浸取时的反应速率;浸取时生成MnSO4和Fe2(SO4)3的化学方程式为9MnO2+2FeS+10H2SO4=9MnSO4+Fe2(SO4)3+10H2O.
(3)滤渣I的成分为MnO2、C和HgS(填化学式);若浸取反应在25℃时进行,FeS足量,则充分浸取后溶液中的$\frac{c(H{g}_{2}^{+})}{C(F{e}_{2}^{+})}$=4.4×10-37(填数值).
(4)“氧化”时的离子方程式为2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O;氧化时可用H2O2代替MnO2,H2O2的电子式为
 .
.(5)中和时,应该调节溶液pH的范围到3.7≤pH<8.3.
20.下列各组微粒中,还原性依次增强的是( )
| A. | I2、Br2、Cl2 | B. | Na+、K+、Cs+ | C. | Cl-、Br-、I- | D. | Al3+、Mg2+、Na+ |
7.下列两组热化学方程式中,有关△H的比较正确的是( )
①NaOH(aq)+$\frac{1}{2}$H2SO4(浓)═$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H1
NaOH(aq)+CH3COOH(aq)═CH3COONa(aq)+H2O(l)△H2
②CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H3
CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H4.
①NaOH(aq)+$\frac{1}{2}$H2SO4(浓)═$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H1
NaOH(aq)+CH3COOH(aq)═CH3COONa(aq)+H2O(l)△H2
②CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H3
CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H4.
| A. | △H1>△H2;△H3<△H4 | B. | △H1>△H2;△H3>△H4 | C. | △H1=△H2;△H3<△H4 | D. | △H1<△H2;△H3>△H4 |
4.摩尔是( )
| A. | 计量微观粒子的物质的量的单位 | B. | 国际单位制的一个基本物理量 | ||
| C. | 表示物质质量的单位 | D. | 表示6.02×1023个粒子的集体 |
5.(常温下)下列关于电解质溶液的正确判断的是( )
| A. | 在pH=12的溶液中,Al3+、Cl-、HCO3-、Na+可以大量共存 | |
| B. | 在pH=0的溶液中,Na+、NO3-、SO32-、K+可以大量共存 | |
| C. | 由0.1 mol/L-元碱BOH溶液的pH=10,可推知BOH溶液存在BOH?B++OH- | |
| D. | pH=2的一元酸和pH=12的一元强碱等体积混后溶液一定存在:c(OH-)=c(H+) |