��Ŀ����
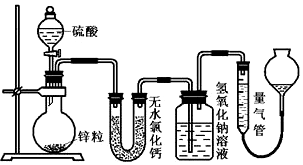
18����ҵ�ϣ���500�����ҵ���м��ͨ��Cl2������ˮ�Ȼ��������Ʊ������о�Ҫȷ����ˮ����ģ��ù�����ͼʾװ�ý���ʵ�飺
��1������a������Ϊ��Һ©����װ��A��Բ����ƿ�з�����Ӧ�Ļ�ѧ����ʽΪMnO2+4HCI��Ũ��$\frac{\underline{\;\;��\;\;}}{\;}$MnCl2+Cl2��+2H2O��Ϊ����װ��CΪ��ˮ������װ��B�м�����Լ���Ũ���ᣮ
��2��ʵ�鲽�裺��ͼ����װ�ú��ȼ��װ�������ԣ���ʵ�����������װҩƷ��Ȼ���ȼA���A����C�������ƾ��ƣ���C�г�������ɫ���壨��ʵ������ʱ���ٵ�ȼC���A����C�������ƾ��ƣ�
��3��װ��D�������dz�ȥδ��Ӧ����������ֹ�����е�ˮ��������Cװ�ã�
��4����ͬѧ��Ϊ����װ��C�������л���HCl��Ӧ��װ��Bǰ����װ�б���ʳ��ˮ�����Լ����ƣ���ϴ��װ�ó�ȥ����ͬѧ��Ϊ����Ҫ��ȥHCl������ΪֻҪ�������������ղ���ֻ���Ȼ�����
���� �������Ϣ��֪��װ��A���Ʊ������ķ���װ�ã����ɵ������к��Ȼ����ˮ������ͨ��װ��B��Ũ�������������ͨ��װ��C��Ӧ������ˮ�Ȼ�����ʣ������ͨ��Dװ���еļ�ʯ�����գ���ͨ��Dװ�����տ����е�ˮ��������ֹ���Ȼ����Ʊ��ĸ��ţ��Դ˽����⣮
��� �⣺��1�������������֪aΪ��Һ©����Aװ����ȡ����������ʵ���ҳ���Ũ������������̼�����ȡ����ѧ��Ӧ����ʽΪ��MnO2+4HCI��Ũ�� $\frac{\underline{\;\;��\;\;}}{\;}$MnCl2+Cl2��+2H2O��Bװ��ʢ��Ũ�������������
�ʴ�Ϊ����Һ©����MnO2+4HCI��Ũ�� $\frac{\underline{\;\;��\;\;}}{\;}$MnCl2+Cl2��+2H2O��Ũ���
��2��ʵ�������������ɣ�����Ҫ�ȼ���ʵ��װ�õ������ԣ�Ϊ�ų�װ���еĿ�����Ӧ�ȵ�ȼA���ľƾ��ƣ����������ų������е�������ˮ������C�г�������ɫ������ٵ�ȼC���ƾ��ƣ�
�ʴ�Ϊ�����װ�������ԣ�A��C�г�������ɫ���壻C��
��3��װ��D�м�ʯ�ҵ������dz�ȥδ��Ӧ������ ��ֹ�����е�ˮ��������Cװ�ã�
�ʴ�Ϊ����ȥδ��Ӧ����������ֹ�����е�ˮ��������Cװ�ã�
��4����ȥ�����е��Ȼ��������ñ���ʳ��ˮ��ֻҪ�������������ղ���ֻ���Ȼ���������Ҫ��ȥ�Ȼ��⣻
�ʴ�Ϊ������ʳ��ˮ��ֻҪ�������������ղ���ֻ���Ȼ�����
���� �������Ȼ����Լ��Ȼ���������ȡΪ���壬�������ʵ��������������ȡ����������β���Ĵ�����������ȷ�����Ʊ�ԭ���������ǽ���ؼ�����Ŀ�Ѷ��еȣ�


| A�� | Y��Q����Ԫ�ص���̬�⻯�P������������ˮ�����Ϊǿ�� | |
| B�� | ����������Ӧˮ����ļ��ԣ�Z��M | |
| C�� | ��̬�⻯����ȶ��ԣ�R��Q | |
| D�� | �����ӵİ뾶��X��Z��M |

��֪��25��ʱ������������ܶȻ����������
| ���� | FeS | MnS | HgS |
| �ܶȻ� | 5.0��l0-18 | 4.6��l0-14 | 2.2��l0-54 |
| ������ | Fe��OH��3 | Fe��OH��2 | Mn��OH��2 |
| ��ʼ������pH | 2.7 | 7.6 | 8.3 |
| ��ȫ������pH | 3.7 | 9.7 | 9.8 |
��2���ڼ��������¡���ȡ������ԭ���Ǽӿ��ȡʱ�ķ�Ӧ���ʣ���ȡʱ����MnSO4��Fe2��SO4��3�Ļ�ѧ����ʽΪ9MnO2+2FeS+10H2SO4=9MnSO4+Fe2��SO4��3+10H2O��
��3������I�ijɷ�ΪMnO2��C��HgS���ѧʽ��������ȡ��Ӧ��25��ʱ���У�FeS���������ֽ�ȡ����Һ�е�$\frac{c��H{g}_{2}^{+}��}{C��F{e}_{2}^{+}��}$=4.4��10-37������ֵ����
��4����������ʱ�����ӷ���ʽΪ2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O������ʱ����H2O2����MnO2��H2O2�ĵ���ʽΪ
 ��
����5���к�ʱ��Ӧ�õ�����ҺpH�ķ�Χ��3.7��pH��8.3��
��NaOH��aq��+$\frac{1}{2}$H2SO4��Ũ���T$\frac{1}{2}$Na2SO4��aq��+H2O��l����H1
NaOH��aq��+CH3COOH��aq���TCH3COONa��aq��+H2O��l����H2
��CH4��g��+2O2��g���TCO2��g��+2H2O��g����H3
CH4��g��+2O2��g���TCO2��g��+2H2O��l����H4��
| A�� | ��H1����H2����H3����H4 | B�� | ��H1����H2����H3����H4 | C�� | ��H1=��H2����H3����H4 | D�� | ��H1����H2����H3����H4 |
| A�� | �⻯ѧ����������ŷ�̼�⻯����͵����������й� | |
| B�� | Ϊ��ֹ�����ն����������Ϲ�������֯Ҫ�������������CO2�Ĺ�ҵ�ŷ��� | |
| C�� | ������˿�ͽ��ڵ���Ҫ�ɷֶ�����ά�� | |
| D�� | Ϊ�˷�ֹ�����±��ȸ���֬ʳƷ�������ʣ��ӳ������ڣ�����װ���з�����ʯ�� |

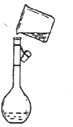 ʵ������Ҫ����100mL 0.1mol•L-1 CuSO4��Һ��
ʵ������Ҫ����100mL 0.1mol•L-1 CuSO4��Һ��