题目内容
6.某混合气体由两种气态烃组成,2.24L该混合气体完全燃烧后,得到4.48L二氧化碳(气体体积已折算为标准状况时的体积)和3.6g水,则两种气态烃可能是( )| A. | CH4和C3H8 | B. | C2H4和C2H6 | C. | CH4和C3H4 | D. | C2H4和C3H4 |
分析 2.24L该混合气体的物质的量为0.1mol,完全燃烧得到4.48L二氧化碳和3.6g水,生成二氧化碳的物质的量为0.2mol,水的物质的量为0.2mol,则混合气体平均分子式为C2H4,据此对各选项进行判断.
解答 解:n(混合烃)=n(CO2)=$\frac{4.48L}{22.4L/mol}$=0.2mol、n(H2O)=$\frac{3.6g}{18g/mol}$=0.2mol,
即0.1mol该混合气体中含有0.2molC原子、0.4molH原子,
所以该烃的平均分子式为C2H4,
①C原子数小于2的烃只有甲烷,所以另一种烃碳个数大于2且氢原子数等于4,可以是CH4、C3H4的混合物,
②若碳个数均为2,则两种烃分子中氢原子个数一个大于4,另一个小于4,
A.CH4和C3H8混合,平均H原子数目介于4~8之间,不可能为4,故A错误;
B.C2H4和C2H6混合,以任意比混合,平均C原子数目都是2,平均H原子数目介于4~6之间,不可能为4,故B错误;
C.CH4和C3H4按照1:1混合,平均分子式为C2H4,故C正确;
D.C2H4和C3H4混合,平均C原子数目介于2~3之间,不可能为2,故D错误;
故选C.
点评 本题考查混合物的计算、有机物分子式的确定,题目难度中等,关键是利用平均分子组成判断烃的组成,注意掌握质量守恒定律在确定有机物分子式中的应用.

练习册系列答案
相关题目
16.已知氢气和气态碘在一定条件下能发生反应:H2(g)+I2(g)?2HI(g)△H=-a kJ•moL-1
已知: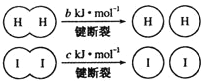
(a、b、c均大于零)下列说法中正确的是( )
已知:

(a、b、c均大于零)下列说法中正确的是( )
| A. | 向密闭容器中加入1 mol H2(g)和2mol I2(g),充分反应后放出的热量有可能等于a kJ | |
| B. | 反应物的总能量低于生成物的总能量 | |
| C. | 断开2 mol H-I键所需能量约为(c+b+a)kJ | |
| D. | 断开1 mol I-I键的同时形成2mol H-I键,说明反应已达到平衡状态 |
17.某化学反应过程的能量变化如图所示.下列说法正确的是( )
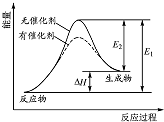

| A. | 该反应的反应物总能量高于生成物总能量 | |
| B. | 使用催化剂可以增大该反应的反应热 | |
| C. | 该化学反应的反应热为E1,且反应放热 | |
| D. | 化学反应在物质变化的同时,必然伴随能量变化 |
14.用下列实验装置完成对应的实验(部分仪器已省略),操作正确并能达到实验目的是( )
| A. |  制备氢氧化亚铁 | B. | 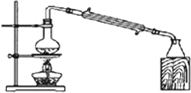 石油的分馏 | ||
| C. | 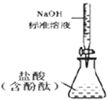 测定盐酸浓度 | D. | 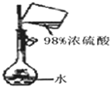 配制稀硫酸 |
1. A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,A与D同主族;C与E同主族;B、C同周期;B原子最外层电子数比其次外层电子数多2;A是周期表中半径最小的元素,C的最外层电子数是内层电子的3倍;F元素是同周期元素中原子半径最小的主族元素.A、B、C、D、E形成的化合物甲、乙、丙、丁的组成如表所示:
A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,A与D同主族;C与E同主族;B、C同周期;B原子最外层电子数比其次外层电子数多2;A是周期表中半径最小的元素,C的最外层电子数是内层电子的3倍;F元素是同周期元素中原子半径最小的主族元素.A、B、C、D、E形成的化合物甲、乙、丙、丁的组成如表所示:
回答下列问题:
(1)指出元素F在周期表中的位置第三周期第ⅦA族.
(2)化合物乙的电子式为 ,用电子式表示形成化合物丁的过程
,用电子式表示形成化合物丁的过程
(3)写出丙与甲反应的离子方程式:2Na2O2+2H2O=4Na++4OH -+O2↑.
(4)固体氧化物燃料电池是以固体氧化锆-氧化钇为电解质,这种固体电解质在高温下允许O2-在其间通过,该电池的工作原理如图所示,其中多孔Pt电极a、b分别是气体C2、A2的载体.该电池的负极为b(填a或b);O2-流向负极(填“正”或“负”);该电池的正极反应式为O2+4 e-=2O2-.
 A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,A与D同主族;C与E同主族;B、C同周期;B原子最外层电子数比其次外层电子数多2;A是周期表中半径最小的元素,C的最外层电子数是内层电子的3倍;F元素是同周期元素中原子半径最小的主族元素.A、B、C、D、E形成的化合物甲、乙、丙、丁的组成如表所示:
A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,A与D同主族;C与E同主族;B、C同周期;B原子最外层电子数比其次外层电子数多2;A是周期表中半径最小的元素,C的最外层电子数是内层电子的3倍;F元素是同周期元素中原子半径最小的主族元素.A、B、C、D、E形成的化合物甲、乙、丙、丁的组成如表所示:| 化合物 | 甲 | 乙 | 丙 | 丁 |
| 化学式 | A2C | A2C2 | D2C2 | D2E |
(1)指出元素F在周期表中的位置第三周期第ⅦA族.
(2)化合物乙的电子式为
 ,用电子式表示形成化合物丁的过程
,用电子式表示形成化合物丁的过程
(3)写出丙与甲反应的离子方程式:2Na2O2+2H2O=4Na++4OH -+O2↑.
(4)固体氧化物燃料电池是以固体氧化锆-氧化钇为电解质,这种固体电解质在高温下允许O2-在其间通过,该电池的工作原理如图所示,其中多孔Pt电极a、b分别是气体C2、A2的载体.该电池的负极为b(填a或b);O2-流向负极(填“正”或“负”);该电池的正极反应式为O2+4 e-=2O2-.
15.下列实验方法能够实现的是( )
| A. | 用10 mL 量筒量取 7.50 mL 稀盐酸 | |
| B. | 用托盘天平称取 25.20 g NaCl晶体 | |
| C. | 用广范 pH试纸测得某碱溶液的pH为12.7 | |
| D. | 用25 mL 碱式滴定管量取14.80 mL NaOH 溶液 |
16.有A、B、C、D主族元素,有关它们的一些信息如表所示:
则下列有关说法中正确的是( )
| 元素 | A | B | C | D |
| 相关的原子结构与性质 | 元素符号为At,与稀有气体元素相邻,但半径比I大 | 其在周期表的周期数和族序数比K的均大1 | 元素符号为Tl,名称是铊,原子核外有六个电子层,与Al同主族 | 可形成双原子分子,分子内有叁键 |
| A. | 元素A的单质可能是一种有色的固体物质,其氢化物HAt易溶于水,很稳定 | |
| B. | 常温下B的单质能与冷水发生剧烈反应,其硫酸盐可能易溶于水 | |
| C. | 铊氧化物化学式为Tl2O3,是离子化合物,Tl2O3和Tl(OH)3均是两性的物质 | |
| D. | 元素D的一些氧化物在大气中会产生光化学烟雾,还会破坏臭氧层 |
