题目内容
18.现有A、B、C、D四种无色溶液,它们分别是稀盐酸、氯化钡、硫酸钠和碳酸钠的某一种.试根据以下实验现象回答下列问题.A+B→白色沉淀 A+C→无变化
A+D→无变化 B+C→白色沉淀
B+D→无变化 C+D→无色气体
(1)写出化学式:ANa2SO4,BBaCl2,CNa2CO3,DHCl.
(2)写出有关反应的离子方程式:
A+B:Ba2++SO42-=BaSO4↓;
B+C:Ba2++CO32-=BaCO3↓.
分析 根据上述转化关系可知B物质能够产生两种沉淀,所以B物质为氯化钡;A、C为硫酸钠和碳酸钠中的一种,即可得D为盐酸,由C和D反应产生气体可知C为碳酸钠,A为硫酸钠,结合物质的性质书写反应的离子方程式.
解答 解:(1)B物质能够产生两种沉淀,所以B物质为BaCl2;A、C为Na2SO4和Na2CO3中的一种,即可得D为HCl,由C和D反应产生气体可知C为Na2CO3,A为Na2SO4,
故答案为:Na2SO4;BaCl2;Na2CO3;HCl;
(2)Na2SO4和BaCl2反应生成BaSO4,反应的离子方程式为Ba2++SO42-=BaSO4↓,Na2CO3和BaCl2反应生成碳酸钡沉淀和氯化钠,反应的离子方程式为Ba2++CO32-=BaCO3↓,
故答案为:Ba2++SO42-=BaSO4↓;Ba2++CO32-=BaCO3↓.
点评 本题主要考查的是物质的鉴别,题目难度不大,注意根据反应的现象判断反应物的可能性,掌握基础是解题关键.

练习册系列答案
相关题目
8.下列说法正确的是( )
| A. | 测定中和热时,所用稀NaOH溶液和HCl的物质的量恰好相等,以减小实验误差 | |
| B. | NaHSO4固体受热变为熔融状态(未发生化学反应),需要克服的作用力有:离子键和共价键 | |
| C. | 在Fe(OH)3胶体中通电,一段时间后,阴极附近颜色加深 | |
| D. | 用蒸馏的方法分离淀粉溶液与Cu(OH)2悬浊液的混合物 |
9.以下是电化学原理的应用问题.
(1)由A、B、C、D四种金属按下表装置图进行实验.
根据实验现象回答问题:四种金属活动性由强到弱的顺序是D>A>B>C.
(2)氢氧燃料电池是符合绿色化学理念的新型发电装置.如图1为电池示意图,请回答:
①氢氧燃料电池的能量转化的主要形式是由化学能转变为电能,在导线中电子流动方向为由a到b(用a、b表示).
②负极反应式为2H2+4OH--4e-=4H2O(或H2+2OH--2e-=2H2O).
(3)如图2中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极.通电一段时间后,在c、d两极上共收集到336mL(标准状况)气体.回答:
①直流电源中,M为正极.
②AgNO3溶液的浓度(填“增大”“减小”或“不变”.下同)不变,H2SO4溶液的浓度增大.
③此时电路中转移电子的物质的量为0.02mol.
(1)由A、B、C、D四种金属按下表装置图进行实验.
| 装置 |  | 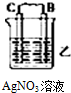 | 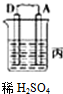 |
| 现象 | 金属A不断溶解 | C极质量增加 | A上有气体产生 |
(2)氢氧燃料电池是符合绿色化学理念的新型发电装置.如图1为电池示意图,请回答:

①氢氧燃料电池的能量转化的主要形式是由化学能转变为电能,在导线中电子流动方向为由a到b(用a、b表示).
②负极反应式为2H2+4OH--4e-=4H2O(或H2+2OH--2e-=2H2O).
(3)如图2中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极.通电一段时间后,在c、d两极上共收集到336mL(标准状况)气体.回答:
①直流电源中,M为正极.
②AgNO3溶液的浓度(填“增大”“减小”或“不变”.下同)不变,H2SO4溶液的浓度增大.
③此时电路中转移电子的物质的量为0.02mol.
6.某混合气体由两种气态烃组成,2.24L该混合气体完全燃烧后,得到4.48L二氧化碳(气体体积已折算为标准状况时的体积)和3.6g水,则两种气态烃可能是( )
| A. | CH4和C3H8 | B. | C2H4和C2H6 | C. | CH4和C3H4 | D. | C2H4和C3H4 |
3.在反应 A(气)?2B(气)+C(气)中,反应物A的浓度在15s内从3.0mol/L变成1.5mol/L,在这15s内B的化学反应速率为( )
| A. | 1.5 mol/(L•s) | B. | 0.5 mol/(L•s) | C. | 0.1 mol/(L•s) | D. | 0.2 mol/(L•s) |
10.下列物质中,既能跟盐酸反应,又能跟氢氧化钠溶液反应的是( )
| A. | NH4NO3 | B. | AlCl3 | C. | Na2CO3 | D. | Al2O3 |
7.下列反应中,水既不做氧化剂、又不做还原剂的氧化还原反应是( )
| A. | 钠和水反应 | B. | 过氧化钠和水反应 | ||
| C. | 氧化钠和水反应 | D. | 二氧化碳和水 |
8.已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中元素A、E的单质常温下呈气态,元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,元素D的合金是日常生活中常用的金属材料,下列说法正确的是( )
| A. | 原子半径:A<B<C<D<E | |
| B. | D单质能够溶解于C的最高价氧化物对应的水化物 | |
| C. | 金属性:D>C | |
| D. | 化合物AE与CE含有相同类型的化学键 |
