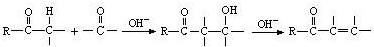题目内容
4.自来水加工处理流程如图,下列有关说法不正确的是( )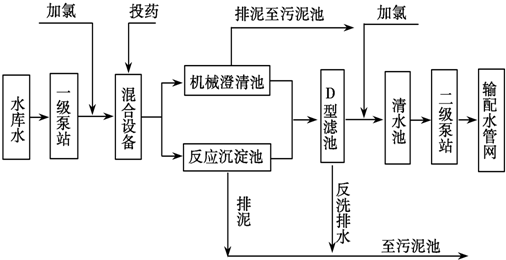
| A. | 若用FeSO4作混凝剂,最终铁将以Fe(OH)2形式进入反应沉淀池 | |
| B. | 投药时常加入适量的石灰,是为了除去水中Mg2+、HCO3-等 | |
| C. | 自来水生产中,前面加氯起消毒杀菌作用,后面加氯是保持水中有效氯的含量,防止自来水二次污染 | |
| D. | 用ClO2消毒自来水,消毒效率是等质量氯气的2.63倍 |
分析 A.亚铁离子易被强氧化剂氧化为铁离子;
B.生石灰和水反应生成氢氧化钙,氢氧化钙和Mg2+、HCO3-都反应,从而除去Mg2+、HCO3-;
C.具有强氧化性,能杀菌消毒;
D.单位质量的气体得到电子数越多,其消毒效率越高.
解答 解:A.亚铁离子具有还原性,含氯物质具有强氧化性,能将亚铁离子氧化为铁离子,所以若用FeSO4作混凝剂,最终铁元素将以Fe(OH)3形式进入反应沉淀池,故A错误;
B.CaO和水反应生成Ca(OH)2,Ca(OH)2和Mg2+产生Mg(OH)2沉淀,和HCO3-生成CaCO3沉淀,从而除去水中的Mg2+、HCO3-等,故B正确;
C.含氯物质具有强氧化性,能使蛋白质变性而杀菌消毒,所以自来水生产中,前加氯起消毒杀菌作用;后加氯是保持水中有效氯的含量,防止自来水二次污染,从而使水更安全,故C正确;
D.ClO2→Cl-得到5个电子,Cl2→2Cl-得到2个电子,且ClO2的摩尔质量小于Cl2,所以单位质量的ClO2比Cl2多得电子,则ClO2消毒效率比同质量氯气高,故D正确;
故选A.
点评 本题以水的净化考查混合物分离提纯的综合应用,为高频考点,把握物质的性质、发生的氧化还原反应及转移电子计算、混合物分离原理为解答的关键,侧重分析与应用能力的考查,注意氧化还原反应的应用,题目难度不大.

练习册系列答案
相关题目
12.用下列装置进行相应实验,能达到实验目的是( )
| A. | 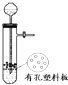 图所示装置用于Cu和浓H2SO4反应制取少量的SO2气体 图所示装置用于Cu和浓H2SO4反应制取少量的SO2气体 | |
| B. | 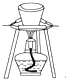 图所示装置用于除去碳酸氢钠固体中的少量碳酸钠 图所示装置用于除去碳酸氢钠固体中的少量碳酸钠 | |
| C. | 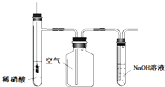 图所示装置用于制备并收集NO气体 图所示装置用于制备并收集NO气体 | |
| D. | 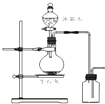 图所示装置制取并收集氨气 图所示装置制取并收集氨气 |
9.地壳中含量居于第二位的金属元素是( )
| A. | Al | B. | Si | C. | Fe | D. | O |
16.如图是部分短周期元素原子半径与原子序数的关系图.字母代表元素,分析正确的是( )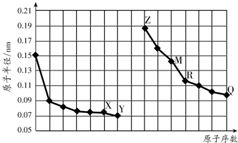

| A. | R在周期表的第15列 | |
| B. | 简单离子的半径:X>Z>M | |
| C. | Y、Q两种元素的气态氢化物及其最高价氧化物的水化物均为强酸 | |
| D. | Z的单质能从M与Q元素构成的盐溶液中置换出单质M |
14.下列过程中,没有发生化学变化的是( )
| A. | 干冰用于人工降雨 | |
| B. | 蔗糖中加入浓硫酸,蔗糖变黑,体积膨胀 | |
| C. | 溶洞中钟乳石的形成 | |
| D. | 豆科作物的根瘤菌对空气中氮的固定 |
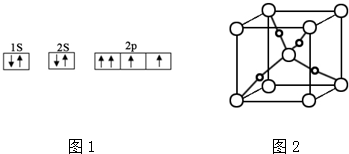
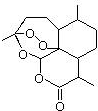
 ,需要在有机合成中引入羟基,引入羟基的反应类型有①②⑤.(选填编号)
,需要在有机合成中引入羟基,引入羟基的反应类型有①②⑤.(选填编号)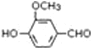 )可用于合成青蒿素,合成天然香草醛的反应如图:
)可用于合成青蒿素,合成天然香草醛的反应如图: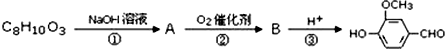
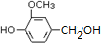 .
.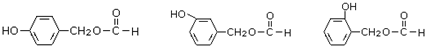 .
.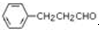 是合成青蒿素的中间原料之一,写出由苯甲醛和氯乙烷为原料,制备苄基乙醛的合成路线流程图(无机试剂任用).
是合成青蒿素的中间原料之一,写出由苯甲醛和氯乙烷为原料,制备苄基乙醛的合成路线流程图(无机试剂任用).