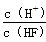题目内容
下列叙述正确的是:
A.向FeCl3溶液中加入镁粉有气泡产生
B.NO2溶于水得到HNO3,所以NO2属于酸性氧化物
C.C12、SO2均能使品红溶液褪色,说明二者均有漂白性
D.向饱和NaC1溶液中先通入足量CO2,再通入足量NH3,可析出NaHCO3晶体
A
【解析】
试题分析: A、FeCl3溶液中存在铁离子的水解平衡Fe3+ + 3H2O  Fe(OH)3 + 3H+,加入镁粉,镁与氢离子反应生成氢气,正确;B、NO2溶于水生成HNO3和NO,所以NO2不属于酸性氧化物,错误; C、C12SO2能使品红溶液褪色表现其漂白性,而C12使品红溶液褪色是氯气与水反应生成具有强氧化性的次氯酸而漂白,氯气没有漂白性,错误;D、应先向饱和NaC1溶液中通入足量NH3,再通入足量CO2,更有利于析出NaHCO3晶体,错误。
Fe(OH)3 + 3H+,加入镁粉,镁与氢离子反应生成氢气,正确;B、NO2溶于水生成HNO3和NO,所以NO2不属于酸性氧化物,错误; C、C12SO2能使品红溶液褪色表现其漂白性,而C12使品红溶液褪色是氯气与水反应生成具有强氧化性的次氯酸而漂白,氯气没有漂白性,错误;D、应先向饱和NaC1溶液中通入足量NH3,再通入足量CO2,更有利于析出NaHCO3晶体,错误。
考点:考查元素化合物知识。

 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案(20分)氮氧化物(NOx)、SO2和CO2等气体会造成环境问题。对燃煤废气进行脱硝、 脱硫和脱碳等处理,可实现绿色环保、节能减排、废物利用等目的。
(1)脱硝。利用甲烷催化还原NOx:
CH4(g) + 4NO2(g) =4NO(g) + CO2(g) + 2H2O(g) △H1=-574 kJ·mol-1
CH4(g) + 4NO(g) =2N2(g) + CO2(g) + 2H2O(g) △H2=-1160 kJ·mol-1
甲烷直接将NO2还原为N2的热化学方程式为 。
(2)脱碳。将CO2转化为甲醇:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H3
CH3OH(g)+H2O(g) △H3
在一恒温恒容密闭容器中充入1 mol CO2和3 mol H2进行上述反应。测得CO2和CH3OH(g)浓度随时间变化如图所示。

则0~10 min内,氢气的平均反应速率为 _______mol/(L·min);第10 min后,保持温度不变,向该密闭容器中再充入1 mol CO2(g)和1 mol H2O(g),则平衡 (填“正向”、“逆向”或“不”)移动。
(3)脱硫。利用Na2SO3溶液可脱除烟气中的SO2。Na2SO3可由NaOH溶液吸收SO2制得。NaOH溶液吸收SO2的过程中,pH随n(SO32-)︰n(HSO3﹣)变化关系如下表:
n(SO32﹣)︰n(HSO3﹣) | 91︰9 | 1︰1 | 9︰91 |
pH | 8.2 | 7.2 | 6.2 |
①由上表判断,NaHSO3溶液显 性,用化学平衡原理解释: 。
②当溶液呈中性时,离子浓度关系正确的是(选填字母): 。
a.c(Na+)=2c(SO32-)+c(HSO3-)
b.c(Na+) > c(HSO3-) > c(SO32-) > c(H+) = c(OH-)
c.c(Na+) + c(H+) = c(SO32-) + c(HSO3-) + c(OH-)
(4)利用下图所示装置(电极均为惰性电极)可吸收SO2,用阴极排出的溶液可吸收NO2。

①阳极的电极反应式为_________________。
②在碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体,同时有 生成。该反应中氧化剂与还原剂的物质的量之比为_______________。
生成。该反应中氧化剂与还原剂的物质的量之比为_______________。
| A、25℃时,pH=4.7浓度均为0.1mol?L-1的CH2COOH、CH3COONa混合溶液中,c(CH3COO-)+c(OH-)<c(CH3COOH)+c(H+) |
| B、常温下,氨水与(NH4)2SO4溶液混合所得pH=7的溶液中,c(NH4+):c(SO42-)=2:1 |
| C、将体积相同,pH均为1的盐酸和醋酸分别加水稀释至pH=3,盐酸的体积变化大,证明醋酸是弱酸 |
| D、向2.0ml浓度均为0.1mol?L-1的KCl、KI混合液中滴加1-2滴0.01mol?L-1AgNO3溶液,振荡,沉淀呈黄色,说明AgCl的Ksp比AgI的Ksp小 |
 和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱: H5IO6 HIO4.(填“>”、“<”或“=”)。H5IO6中α键与π键的个数比为 。
和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱: H5IO6 HIO4.(填“>”、“<”或“=”)。H5IO6中α键与π键的个数比为 。
 Na2S2O3(aq)
Na2S2O3(aq)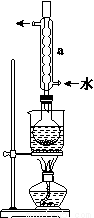
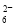 +2I-
+2I-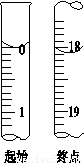
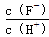 D.
D.