题目内容
1.发展储氢技术是氢氧燃料电池推广应用的关键.研究表明液氨是一种良好的储氢物质,其储氢容量可达17.6%(质量分数).液氨气化后分解产生的氢气可作为燃料供给氢氧燃料电池.氨气分解反应的热化学方程式如下:2NH3(g)?N2 (g)+3H2(g)△H=92.4kJ•mol-1
请回答下列问题:
(1)氨气自发分解的反应条件是高温.
(2)已知:2H2(g)+O2 (g)=2H2O(g)△H=-483.6kJ•mol-1
NH3(l)?NH3 (g)△H=23.4kJ•mol-1
则,反应 4NH3(l)+3O2 (g)═2N2(g)+6H2O(g) 的△H=-1172.4kJ•mol-1.
(3)研究表明金属催化剂可加速氨气的分解.图1为某温度下等质量的不同金属分别催化等浓度氨气分解生成氢气的初始速率.
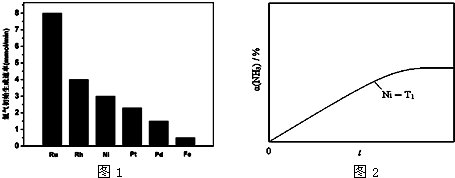
①不同催化剂存在下,氨气分解反应的活化能最大的是Fe(填写催化剂的化学式).
②恒温(T1)恒容时,用Ni催化分解初始浓度为c0的氨气,并实时监测分解过程中氨气的浓度.计算后得氨气的转化率α(NH3)随时间t变化的关系曲线(见图2).请在图2中画出:在温度为T1,Ru催化分解初始浓度为c0的氨气过程中α(NH3) 随t变化的总趋势曲线(标注Ru-T1).
③如果将反应温度提高到T2,请在图2中再添加一条Ru催化分解初始浓度为c0的氨气过程中α(NH3)~t的总趋势曲线(标注Ru-T2)
④假设Ru催化下温度为T1时氨气分解的平衡转化率为40%,则该温度下此分解反应的平衡常数K与c0的关系式是:K=0.12c02.
(4)用Pt电极对液氨进行电解也可产生H2和N2.阴极的电极反应式是2NH3+2e-═H2+2NH2-;阳极的电极反应式是2NH3-6e-═N2+6H+.(已知:液氨中2NH3(l)?NH2-+NH4+)
分析 (1)氨分解反应的焓变△H>0,熵变△S>0,由反应自发性的综合判据△H-T△S<0来回答;
(2)①2NH3(g)?N2 (g)+3H2(g)△H=92.4kJ•mol-1
②2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ•mol-1
③NH3(l)?NH3 (g)△H=23.4kJ•mol-1
③×4+①×2+②×3得:4NH3(l)+3O2 (g)═2N2(g)+6H2O(g)由盖斯定律计算焓变;
(3)①从图1可看出,Fe作催化剂时,氨分解的活化能最大;
②温度不变,则平衡常数不变,平衡状态也不变;
③温度升高,平衡正向移动,氨气的转化率α(NH3)增大,反应速率大;
④氨气的起始浓度为c0,平衡浓度为0.6c0,氨气的转化浓度为0.4c0,则N2的平衡浓度为0.2c0,H2的平衡浓度为0.6c0,据此计算K;
(4)Pt为惰性电极,对液氨进行电解时,阴极NH2-得电子生成H2,阳极NH4+失电子生成N2.
解答 解:(1)氨分解反应的焓变△H>0,熵变△S>0,由反应自发性的综合判据△H-T△S<0,即T>$\frac{△H}{△S}$可知氨自发分解的条件应该是高温.故答案为:高温;
(2)①2NH3(g)?N2 (g)+3H2(g)△H=92.4kJ•mol-1
②2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ•mol-1
③NH3(l)?NH3 (g)△H=23.4kJ•mol-1
③×4+①×2+②×3得:4NH3(l)+3O2 (g)═2N2(g)+6H2O(g)
由盖斯定律可得:△H=23.4kJ•mol-1×4+92.4kJ•mol-1×2+(-483.6kJ•mol-1)×3=-1172.4kJ•mol-1.故答案为:-1172.4kJ•mol-1;
(3)①从图1可看出,Fe作催化剂时,氢气的初始生成速率最小,根据碰撞理论的解释,催化剂的催化原理实质上是降低反应的活化能,活化能越低,则活化分子百分数越高,反应速率越大,所以上述金属比较,铁作催化剂时,氨分解的活化能最大.故答案为:Fe;
②温度不变,则平衡常数不变,平衡状态也不变,但金属钌(Ru)的催化效果比镍(Ni)显著,所以反应到达平衡所需时间短,答案见图曲线Ru-T1,故答案为: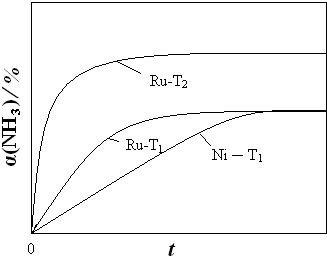 ;
;
③温度升高,平衡正向移动,氨气的转化率α(NH3)增大,反应速率大,反应到达平衡的时间缩短,答案见图曲线 Ru-T2.故答案为: ;
;
④氨气的起始浓度为c0,平衡浓度为0.6c0,氨气的转化浓度为0.4c0,则N2的平衡浓度为0.2c0,H2的平衡浓度为0.6c0,故K=$\frac{0.2{c}_{0}×(0.6{c}_{0})^{3}}{(0.6{c}_{0})^{2}}$=0.12c02,
故答案为:0.12c02;
(4)Pt为惰性电极,对液氨进行电解时,阴极NH2-得电子生成H2,阳极NH4+失电子生成N2,其电极反应分别为:2NH3+2e-═H2+2NH2-;2NH3-6e-═N2+6H+.
故答案为:2NH3+2e-═H2+2NH2-;2NH3-6e-═N2+6H+.
点评 本题考查反应的自发性判断、盖斯定律的应用、化学反应速率和化学平衡的影响因素、化学平衡常数的计算、电极反应式的书写等及图象分析能力与分析解决化学问题的能力.

| A. | 5 种 | B. | 6 种 | C. | 7 种 | D. | 8 种 |
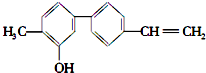
| A. | 由于含有氧元素不是有机物 | B. | 该物质的分子式是 C15H14O | ||
| C. | 分子中含有羟基属于醇 | D. | 分子中有三种官能团 |
| A. | 常温常压下,11.2 L CO和CO2混合气体中含有的碳原子数目为0.5NA | |
| B. | 标准状况下,7.1 g氯气与足量氢氧化钠溶液反应转移的电子数为2NA | |
| C. | 92 g NO2和N2O4的混合气体中含有的原子总数为6NA | |
| D. | 100 g 17%的氨水,溶液中含有的NH3分子数为NA |
| A. | 盐酸 | B. | CO2 | C. | HNO3 | D. | 乙醇 |
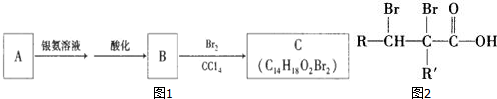
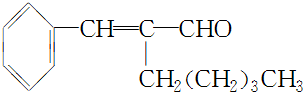 .
. +CH3CH2OH$→_{△}^{浓H_{2}SO_{4}}$
+CH3CH2OH$→_{△}^{浓H_{2}SO_{4}}$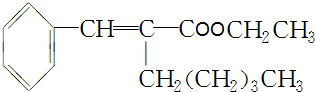 +H2O.
+H2O.