题目内容
9.如图1有机物A为茉莉香型香料.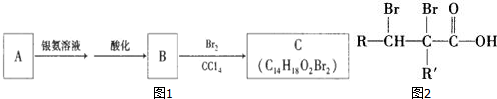
(1)A分子中官能团的名称是醛基、碳碳双键.
(2)C的分子结构可表示为(其中R和R′代表不同的烃基)(图2)
A的化学式是C14H18O,A可以发生的反应是a(填写序号字母).
a.还原反应 b.消去反应 c.酯化反应 d.水解反应
(3)已知含有烃基R的有机物R-OH与浓溴水反应产生白色沉淀,则含有烃基R′的有机物R′-OH的类别属于醇.
(4)A分子结构中只有一个甲基,A的结构简式是
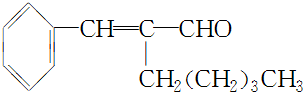 .
.(5)在浓硫酸存在下,B与乙醇共热生成化合物C16H22O2的化学方程式是
 +CH3CH2OH$→_{△}^{浓H_{2}SO_{4}}$
+CH3CH2OH$→_{△}^{浓H_{2}SO_{4}}$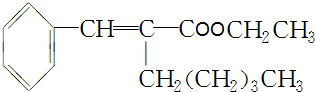 +H2O.
+H2O.(6)写出符合下列条件的有机物R-CH=CHCH2COOH的同分异构体有5种(不考虑物质的稳定性).
a.能发生银镜反应
b.能在无机酸作用下发生水解反应
c.该有机物中羟基R上的一氯代物有两种
d.除苯环外不含其它环状结构.
分析 A能够发生银镜反应,则A中一定含有官能团醛基,由C的分子式及其结构特点,且含有烃基R的有机物R-OH与浓溴水反应产生白色沉淀,所以C中R为苯基,则R′为-CH2CH2CH2CH2CH3,由转化关系可知,A分子结构中只有一个甲基,A发生氧化反应生成B,B与溴发生加成反应生成C,则A为 ,B为
,B为 ,据此答题.
,据此答题.
解答 解:A能够发生银镜反应,则A中一定含有官能团醛基,由C的分子式及其结构特点,且含有烃基R的有机物R-OH与浓溴水反应产生白色沉淀,所以C中R为苯基,则R′为-CH2CH2CH2CH2CH3,由转化关系可知,A分子结构中只有一个甲基,A发生氧化反应生成B,B与溴发生加成反应生成C,则A为 ,B为
,B为 ,
,
(1)A为 ,A中含有的官能团为碳碳双键、醛基,故答案为:醛基;碳碳双键;
,A中含有的官能团为碳碳双键、醛基,故答案为:醛基;碳碳双键;
(2)A为 ,所以A的分子式为C14H18O;A含有碳碳双键和醛基,能够发生加成反应、还原反应,不能发生消去、酯化和水解,所以a正确,
,所以A的分子式为C14H18O;A含有碳碳双键和醛基,能够发生加成反应、还原反应,不能发生消去、酯化和水解,所以a正确,
故答案为:C14H18O;a;
(3)已知含有烃基R的有机物R-OH与浓溴水反应产生白色沉淀,则R为苯环,烃基R′中含有5个C原子,R′-OH属于醇类,
故答案为:醇;
(4)根据 上面的分析可知,A为: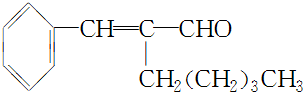 ,
,
故答案为: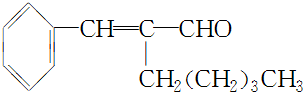 ;
;
(5)B为 在浓硫酸存在下,B与乙醇共热生成化合物C16H22O2为
在浓硫酸存在下,B与乙醇共热生成化合物C16H22O2为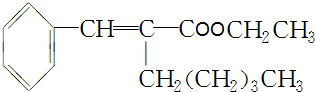 ,反应的化学方程式是
,反应的化学方程式是 +CH3CH2OH$→_{△}^{浓H_{2}SO_{4}}$
+CH3CH2OH$→_{△}^{浓H_{2}SO_{4}}$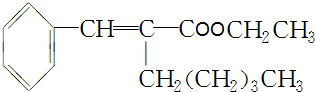 +H2O,
+H2O,
故答案为: +CH3CH2OH$→_{△}^{浓H_{2}SO_{4}}$
+CH3CH2OH$→_{△}^{浓H_{2}SO_{4}}$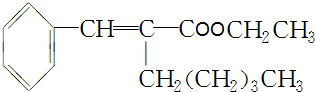 +H2O;
+H2O;
(6)R为苯基,根据条件a.能发生银镜反应,说明有醛基,b.能在无机酸作用下发生水解反应,说明有酯基,c.该有机物中羟基R上的一氯代物有两种,说明有两个处于对位的基团,d.除苯环外不含其它环状结构,则符合条件的有机物R-CH=CHCH2COOH的同分异构体为苯环的对位连有-CH3、HCOOCH=CH-,或-CH=CHCH3、HCOO-,或-C(CH3)=CH2、HCOO-,或-CH2CH=CH2、HCOO-,或-CH=CH2、HCOOCH2-,共有5种,
故答案为:5.
点评 本题考查有机物的推断,题目难度中等,需要根据C的结构特点与反应条件进行推断,侧重于学生的分析能力和有机物的综合利用的考查,注意掌握常见有机物结构与性质.

| A. | 氧化剂和还原剂的物质的量之比为1:8 | |
| B. | 当有1mol Cl2生成时,有0.5 mol电子发生转移 | |
| C. | 氧化产物是MnCl2,还原产物Cl2 | |
| D. | 相同物质的量的KMnO4和MnO2分别与足量浓盐酸充分反应产生Cl2质量之比为5:2. |
①1-甲基丙烷
②3,4-二甲基戊烷
③2-乙基丁烷
④3-乙基-2-甲基戊烷.
| A. | 只有②③ | B. | 只有③④ | C. | 都正确 | D. | 都错误 |
a 12g 金刚石中含有的碳碳键的数目为2NA
b 1mol 明矾与水完全反应转化为氢氧化铝胶体后,其中胶体粒子的数目为NA
c 1mol Na2O2与水反应转移的电子数为NA
d 常温下,1mol•L-1的NH4NO3溶液中含有氮原子的数目为2NA
e 常温下,30g SiO2晶体中含有Si-O键的数目为NA
f 17g H2O2中含有的电子数为9NA
g 将2mol SO2与1mol O2混合,发生反应转移的电子总数一定是4NA
h 常温下,100mL 1mol•L-1 AlCl3溶液中阳离子总数大于0.1NA.
| A. | a c f h | B. | a c e g | C. | a c e f h | D. | b d e h |
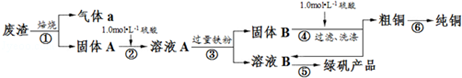
(1)在实验室中,欲用98%的浓硫酸(密度为1.84g•mL-1)配制500mL1.0mol•L-1的硫酸,需要的仪器除量筒、烧杯、玻璃棒外,还有胶头滴管、500mL容量瓶.
(2)该小组同学设计如图装置模拟废渣在过量氧气中焙烧,并验证废渣中含硫元素.

①装置A中反应的化学方程式为2Na2O2+2H2O=4NaOH+O2↑;为控制反应不过于激烈并产生平稳气流,采取的操作及现象是打开分液漏斗上口活塞,控制分液漏斗旋塞,使水匀速逐滴滴下;B处应连接盛有碱石灰的干燥管(或U形管)或浓硫酸的洗气瓶(填写试剂及仪器名称).
②E装置中加入品红溶液的目的是检验气体a中的SO2;当F装置中出现白色沉淀时,反应离子方程式为2SO2+O2+2H2O+2Ba2+=2BaSO4↓+4H+.
(3)下列操作中,不属于步骤⑤中进行的操作的是ad(填下列各项中序号).
(4)为测定产品中绿矾的质量分数,称取30.000g样品溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.1000mol•L-1酸性KMnO4溶液进行滴定,反应为:10FeSO4+8H2SO4+2KMnO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O.实验所得数据如下表所示:
| 滴定次数 | 1 | 2 | 3 | 4 |
| KMnO4溶液体积/mL | 20.90 | 20.02 | 19.98 | 20.00 |
a.酸式滴定管用蒸馏水洗净后未用标准液润洗 b.锥形瓶洗净后未干燥
c.滴定终点时俯视读数 d.滴定终点时仰视读数
②根据表中数据,计算所得产品中绿矾的质量分数为92.7%.

| A. | 与乙苯互为同系物 | B. | 分子中共直线的原子最多有4个 | ||
| C. | 分子中共平面的碳原子最多有13个 | D. | 与甲苯互为同分异构体 |
(1)卤族元素位于元素周期表的P区;溴的价电子排布式为4s24p5.
(2)在一定浓度的溶液中,氢氟酸是以二分子缔合(HF)2形式存在的.使氢氟酸分子缔合的作用力是氢键.
(3)请根据下表提供的第一电离能数据判断,最有可能生成较稳定的单核阳离子的卤素原子是碘(写出名称).
| 氟 | 氯 | 溴 | 碘 | |
| 第一电离能(kJ/mol) | 1681 | 1251 | 1140 | 1008 |
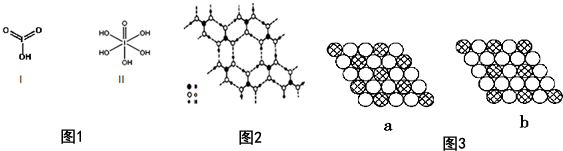
请比较二者酸性强弱:HIO3> H5IO6(填“>”、“<”或“=”).
(5)硼酸(H3BO3)是一种片层状结构的白色晶体,层内的H3B03分子间通过氢键相连(如图2).则1molH3BO3的晶体中有3 mol氢键.
硼酸溶于水生成弱电解质一水合硼酸B(OH)3•H2 O,它电离生成少量[B(OH)4]一和H+,则[B(OH)4]一含有的化学键类型为共价键、配位键.
(6)如图所示的二维平面晶体示意图3中表示化学式为AX3的是b.