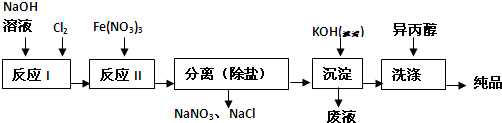
题目内容
A、B、C、D、E是原子序数依次增大的短周期主族元素.A元素可形成多种同素异形体,其中一种是自然界最硬的物质;B的原子半径在短周期主族元素中最大;C原子核外电子占据7个不同的原子轨道;D的单质在常温常压下是淡黄色固体.
(1)E在元素周期表中的位置 ;B的基态原子核外电子排布式为 .
(2)A、D、E中电负性最大的是 (填元素符号);B、C两元素第一电离能较大的是 (填元素符号).
(3)A和D两元素非金属性较强的是 (填元素符号),写出能证明该结论的一个事实依据 .
(4)化合物AD2分子中共有 个α键和 个π键,AD2分子的空间构型是 .
(5)C与E形成的化合物在常温下为白色固体,熔点为190℃,沸点为182.7℃,在177.8℃升华,推测此化合物为 晶体.工业上制取上述无水化合物方法如下:C的氧化物与A、E的单质在高温条件下反应,已知每消耗12kgA的单质,过程中转移2×l03mol e-,写出相应反应的化学方程式: .
(1)E在元素周期表中的位置
(2)A、D、E中电负性最大的是
(3)A和D两元素非金属性较强的是
(4)化合物AD2分子中共有
(5)C与E形成的化合物在常温下为白色固体,熔点为190℃,沸点为182.7℃,在177.8℃升华,推测此化合物为
考点:位置结构性质的相互关系应用,元素电离能、电负性的含义及应用
专题:元素周期律与元素周期表专题
分析:A、B、C、D、E是原子序数依次增大的短周期主族元素.A元素可形成多种同素异形体,其中一种是自然界最硬的物质,故A是碳元素;B的原子半径在短周期主族元素中最大,故B为钠元素;C原子核外电子占据7个不同的原子轨道,即证据1s1个轨道、2s1个轨道、2p3个轨道、3s1个轨道、3p1个轨道,即C为铝元素;D的单质在常温常压下是淡黄色固体,故D是硫元素,E的原子序数大于S,且属于短周期,主族,故E是氯元素,据此解答各小题即可.
解答:
解:依据分析可知:A为C,B为Na,C为Al,D为S,E为Cl,
(1)E为Cl,Cl处于第三周期第ⅦA族,B为钠,Na的核外电子排布式为:1s22s22p63s1,故答案为:第三周期第ⅦA族;1s22s22p63s1;
(2)C、S、Cl中,非金属性越强,其电负性越大,由于非金属性:Cl>S>C,故电负性最大的是Cl,Na与Al比较,金属性越强,第一电离能越小,由于金属性Na>Al,故第一电离能Al>Na,故答案为:Cl;Al;
(3)C与S非金属性较强的是硫,依据非金属的最高价氧化物对应的水化物的酸性越强,其非金属性越强,碳酸是弱酸,而硫酸是强酸,故答案为:S;H2CO3是弱酸,H2SO4是强酸;
(4)AD2为CS2,CS2结构类似于CO2,即C与2个S分别形成两对共价键,即含有2个Π键,2个α键,形成直线形分子,故答案为:2;2;直线型;
(5)Al与Cl形成的化合物为:AlCl3,AlCl3固体的熔沸点较低,即AlCl3固体为共价化合物形成的分子晶体分子,依据题意得知氧化铝与碳单质、氯气在高温条件下反应,反应中每消耗12kgC,即物质的量为:
=1000mol,1000molC反应转移2×l03mol e-,故C被氧化为+2价,故产物为CO,据此写反应方程式为:Al2O3+3C+3Cl2
3CO+2AlCl3,故答案为:Al2O3+3C+3Cl2
3CO+2AlCl3.
(1)E为Cl,Cl处于第三周期第ⅦA族,B为钠,Na的核外电子排布式为:1s22s22p63s1,故答案为:第三周期第ⅦA族;1s22s22p63s1;
(2)C、S、Cl中,非金属性越强,其电负性越大,由于非金属性:Cl>S>C,故电负性最大的是Cl,Na与Al比较,金属性越强,第一电离能越小,由于金属性Na>Al,故第一电离能Al>Na,故答案为:Cl;Al;
(3)C与S非金属性较强的是硫,依据非金属的最高价氧化物对应的水化物的酸性越强,其非金属性越强,碳酸是弱酸,而硫酸是强酸,故答案为:S;H2CO3是弱酸,H2SO4是强酸;
(4)AD2为CS2,CS2结构类似于CO2,即C与2个S分别形成两对共价键,即含有2个Π键,2个α键,形成直线形分子,故答案为:2;2;直线型;
(5)Al与Cl形成的化合物为:AlCl3,AlCl3固体的熔沸点较低,即AlCl3固体为共价化合物形成的分子晶体分子,依据题意得知氧化铝与碳单质、氯气在高温条件下反应,反应中每消耗12kgC,即物质的量为:
| 12000g |
| 12g/mol |
| ||
| ||
点评:本题主要考查的是元素的推断,涉及原子核外电子排布式、电负性比较、第一电离能大小比较、氧化还原反应等知识点,综合性较强,属于中等难度的题目.

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案
相关题目
用氢氧化钠的标准溶液滴定待测酸的浓度时,用酚酞作指示剂,达到滴定终点时,溶液的颜色变化是( )
| A、由无色变为红色 |
| B、由无色变为浅红色 |
| C、由红色变为无色 |
| D、由红色变为浅红色 |
下列仪器中使用前不需要检验是否漏水的是( )
| A、滴定管 | B、分液漏斗 |
| C、过滤漏斗 | D、容量瓶 |