题目内容
9.把Ba(OH)2溶液滴入明矾溶液中,使SO42ˉ全部转化成BaSO4沉淀,此时铝元素的主要存在形式是( )| A. | AlO2ˉ | B. | Al3+ | C. | Al(OH)3 | D. | Al3+和Al(OH)3 |
分析 明矾的化学式为KAl(SO4)2•12H2O,设明矾为1mol,则溶液中含有1molAl3+,2molSO42-,使SO42-恰好全部转化为BaSO4沉淀,发生SO42-+Ba2+=BaSO4↓、Al3++4OH-=AlO2-+2H2O,以此来解答.
解答 解:明矾的化学式为KAl(SO4)2•12H2O,设明矾为1mol,则溶液中含有1molAl3+,2molSO42-,由反应SO42-+Ba2+=BaSO4↓可知,使SO42-全部转化成BaSO4沉淀,需要2molBa(OH)2,则加入4molOH-,则发生Al3++4OH-=AlO2-+2H2O,所以最后溶液中存在AlO2-,
故选A.
点评 本题考查离子反应方程式,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重分析与应用能力的考查,明确与量有关的离子反应中量少的物质完全反应,注意离子反应中保留化学式的物质及电荷守恒,题目难度不大.

练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目
19.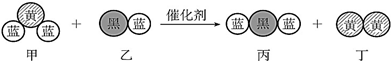 汽车尾气中常常含有CO、NOx等气体,为减轻污染,当代汽车都加装了“三效催化净化器”,可将汽车尾气中的有毒气体处理为无污染的气体,如图为该反应的微观示意图(未配平),其中不同符号的球代表不同种原子.下列说法不正确的是( )
汽车尾气中常常含有CO、NOx等气体,为减轻污染,当代汽车都加装了“三效催化净化器”,可将汽车尾气中的有毒气体处理为无污染的气体,如图为该反应的微观示意图(未配平),其中不同符号的球代表不同种原子.下列说法不正确的是( )
 汽车尾气中常常含有CO、NOx等气体,为减轻污染,当代汽车都加装了“三效催化净化器”,可将汽车尾气中的有毒气体处理为无污染的气体,如图为该反应的微观示意图(未配平),其中不同符号的球代表不同种原子.下列说法不正确的是( )
汽车尾气中常常含有CO、NOx等气体,为减轻污染,当代汽车都加装了“三效催化净化器”,可将汽车尾气中的有毒气体处理为无污染的气体,如图为该反应的微观示意图(未配平),其中不同符号的球代表不同种原子.下列说法不正确的是( )| A. | 甲、乙、丙、丁中有3 种非极性分子 | |
| B. | 甲和丁中同种元素化合价不相等 | |
| C. | H2CO3、HNO3的相对强弱与分子中键的极性相关 | |
| D. | N2O5的水化物中不存在氢键 |
20.下列各组离子在溶液中能够大量共存的是( )
| A. | H+、Fe2+、Na+、NO3- | B. | NH4+、NO3-、Na+、SO42- | ||
| C. | Ba2+、K+、Al3+、HCO3- | D. | NH4+、Li+、OH-、SiO32- |
17.下列离子方程式书写正确的是( )
| A. | Fe与稀硝酸:Fe+2HNO3→Fe2++H2↑ | |
| B. | 澄清石灰水与少量小苏打溶液混合:Ca2+十OH-+HCO3-→CaCO3↓+H2O | |
| C. | AlCl3溶液中加入过量氨水:Al3++4OH-→AlO2-+2H2O | |
| D. | FeS固体放人稀硫酸溶液中:FeS+2H+→Fe2++H2S↑ |
4.定量实验是化学的重要组成部分.下列关于学习定量测定的说法中正确的是( )
| A. | 主要学习实验方法,体验一下实验操作即可,不必追求精确 | |
| B. | 应该先做好实验报告,并事先填好,再做实验 | |
| C. | 要实事求是地记录自己的测定结果 | |
| D. | 本组实验失误,实验报告可以参照邻组的结果 |
14.在硫化钠溶液中,c(Na+)与c(S2-)的关系是( )
| A. | c(Na+):c(S2-)=1:1 | B. | c(Na+):c(S2-)>2:1 | C. | c(Na+):c(S2-)=2:1 | D. | c(Na+):与c(S2-)<2:1 |
1.某化合物6.4克在氧气中完全燃烧,只生成8.8克CO2和7.2gH2O.下列说法正确的是( )
| A. | 该化合物仅含碳、氢两种元素 | B. | 该化合物中碳氢原子个数比为1:2 | ||
| C. | 该化合约中一定含有氧元素 | D. | 若要确定其分子式一定需要质谱仪 |
18.设NA为阿伏伽德罗常数的值,下列有关说法正确的是( )
| A. | 电子数总为10NA的NH4+中含有质子的物质的量为10mol | |
| B. | 在标准状况下,所含氯原子数为3NA的CHCL3体积约为22.4L | |
| C. | 足量氢氧化钠溶液中通入lmolCL2,反应中转移的电子数NA | |
| D. | 在标准状况下,气体体积约为22.4L的O2和O3组成的混合气原子总数为1.5NA |
19.1g氮气含有m个分子,则阿伏加德罗常数的值可表示为( )
| A. | $\frac{m}{28}$ | B. | m | C. | $\frac{m}{14}$ | D. | 28m |