题目内容
14.在硫化钠溶液中,c(Na+)与c(S2-)的关系是( )| A. | c(Na+):c(S2-)=1:1 | B. | c(Na+):c(S2-)>2:1 | C. | c(Na+):c(S2-)=2:1 | D. | c(Na+):与c(S2-)<2:1 |
分析 在硫化钠中能电离出钠离子和硫离子,硫离子水解,导致硫离子浓度会减小.
解答 解:硫化钠中能电离出钠离子和硫离子,电离出的钠离子浓度应是硫离子浓度的2倍,但是硫离子一部分会水解,导致硫离子浓度会减小,所以c(Na+):c(S2-)>2:1.
故选B.
点评 本题考查学生盐的水解和电离知识,可以根据所学知识进行回答,难度不大.

练习册系列答案
相关题目
5.能把AlCl3、(NH4)2SO4、KCl、MgCl2四种溶液鉴别出来的一种试剂是( )
| A. | 硝酸银溶液 | B. | 氢氧化钠溶液 | C. | 氨水 | D. | 硝酸钡溶液 |
2.工业上用铝热反应来冶炼某些难熔的金属.用铝热反应冶炼出的金属的状态是( )
| A. | 固态 | B. | 液态 | ||
| C. | 气态 | D. | 三种状态都有可能 |
9.把Ba(OH)2溶液滴入明矾溶液中,使SO42ˉ全部转化成BaSO4沉淀,此时铝元素的主要存在形式是( )
| A. | AlO2ˉ | B. | Al3+ | C. | Al(OH)3 | D. | Al3+和Al(OH)3 |
19.在通常条件下,下列各组物质的比较排列不正确的是( )
| A. | 沸点:乙烷>戊烷>2-甲基丁烷 | B. | 同分异构体种类:戊烷<戊烯 | ||
| C. | 密度:苯<水<硝基苯 | D. | 共线碳原子数:1,3-丁二烯>丙炔 |
6.如表是部分短周期元素的原子半径和主要化合价.
用化学用语回答:
(1)Z元素在周期表中的位置第三周期VIIA族.
(2)表格中是否含有短周期主族元素原子半径最大的元素是(填“是”或“否”).
(3)X和Y可以形成18e-化合物,其电子式 .
.
(4)Q元素的原子结构示意图 .
.
( 5 ) Y、M分别形成的常见氢化物沸点H2O>H2S;原因是水分子中含有氢键,故沸点高于硫化氢.
| 元素代号 | X | Y | Z | W | M | Q |
| 原子半径/nm | 0.037 | 0.074 | 0.099 | 0.186 | 0.102 | 0.143 |
| 主要化合价 | +1 | -2 | -1、+7 | +1 | -2、+6 | +3 |
(1)Z元素在周期表中的位置第三周期VIIA族.
(2)表格中是否含有短周期主族元素原子半径最大的元素是(填“是”或“否”).
(3)X和Y可以形成18e-化合物,其电子式
 .
.(4)Q元素的原子结构示意图
 .
.( 5 ) Y、M分别形成的常见氢化物沸点H2O>H2S;原因是水分子中含有氢键,故沸点高于硫化氢.

 如图示实验室化学试剂浓硫酸标签上的部分内容.现需要490ml1.0moL•L-1H2SO4溶液.用该浓硫酸和蒸馏水配制,可供选用的仪器有:
如图示实验室化学试剂浓硫酸标签上的部分内容.现需要490ml1.0moL•L-1H2SO4溶液.用该浓硫酸和蒸馏水配制,可供选用的仪器有: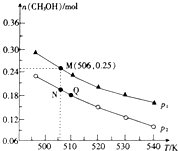 二氧化碳是常见的温室气体,其回收利用是环保领域研究的热点课题.回答下列问题:
二氧化碳是常见的温室气体,其回收利用是环保领域研究的热点课题.回答下列问题: