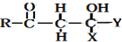题目内容
18.硫化氢具有还原性,可以和许多氧化剂反应.用氧化还原反应原理配平下列反应,并填空:□KMnO4+□H2S+□H2SO4═□K2SO4+□MnSO4+□S↓+□H2O
(1)请配平上述化学方程式,将有关的化学计量数依次填在下列横线上
2、5、3、1、2、5、8
(2)上述反应中还原剂为H2S,还原产物为MnSO4(填化学式).
(3)若参与反应的H2S为3.4g则反应转移的电子数目为0.2NA.
分析 (1)根据化合价升降总数相等和质量守恒来配平方程式;
(2)根据化合价升高的反应物是还原剂,其对应产物为氧化产物来回答;
(3)根据电子转移情况和参加反应的各个物质的量之间的关系来计算即可.
解答 解:(1)H2S和KMnO4反应生成S、MnSO4、K2SO4和H2O,反应的方程式为2KMnO4+5H2S+3H2SO4=K2SO4+2MnSO4+5S↓+8H2O,
故答案为:2;5;3;1;2;5;8;
(2)H2S中S的化合价由-2价升高为0价,是还原剂,所以对应的产物S 是氧化产物,KMnO4被还原生成还原产物为MnSO4;
故答案为:H2S;MnSO4;
(3)1molH2S在反应中失电子为2mol,若参与反应的H2S为3.4g即0.1mol,则转移的电子数目为0.2NA;
故答案为:0.2NA.
点评 本题主要考查了氧化还原反应的配平、基本概念、电子得失守恒的运用,题目难度不大,注意基础知识的掌握,侧重于考查学生的分析能力和计算能力.

练习册系列答案
相关题目
8.X、Y、Z、W、R五种短周期元素原子序数依次增大,X原子是所有原子中半径最小的,Y、R同主族,Z、W、R同周期,Y原子的最外层电子数是次外层的3倍,Z是常见的金属,其氢氧化物能溶于强碱溶液但不溶于氨水,W单质是人类将太阳能转变为电能的常用材料,下列相关说法正确的是( )
| A. | W的最高价氧化物对应的水化物难溶于水 | |
| B. | 原子半径按X、Y、Z、R、W的顺序依次增大 | |
| C. | Z与Y形成的化合物是碱性氧化物 | |
| D. | WY2能与强碱溶液反应,但不能与任何酸反应 |
9.下列各组混合物中,可以用分液漏斗分离的是( )
| A. | 溴苯和水 | B. | 乙酸和水 | C. | 酒精和水 | D. | 硝基苯和苯 |
6.水溶液中能大量共存的一组离子是( )
| A. | Na+、Ba2+、Cl-、SO42- | B. | Fe2+、H+、S2-、ClO- | ||
| C. | Mg2+、NH4+、Cl-、SO42- | D. | K+、OH-、NO3-、HSO3- |
13.选用如图所示仪器中的两个或几个(内含物质)组装成实验装置,以验证木炭可被浓硫酸氧化成CO2,下列说法正确的是( )
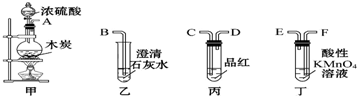

| A. | 按气流从左向右流向,连接装置的正确顺序是A→C→D→F→E→B | |
| B. | 丁中溶液褪色,乙中溶液变浑浊说明甲中生成CO2 | |
| C. | 丙中品红溶液不褪色,乙中溶液变浑浊说明甲中生成CO2 | |
| D. | 丁和丙中溶液都褪色,乙中溶液变浑浊,说明甲中有CO2生成 |
3.关于丙醇(CH3CH2CH2OH)分子的说法正确的是( )
| A. | 分子中共含有11个极性键 | B. | 分子中含有配位键 | ||
| C. | 分子中只含σ键 | D. | 分子中含有1个π键 |
10.下列各组物质中,互称为同分异构体的是( )
| A. | 水与冰 | B. | O2与O3 | C. | 石墨与金刚石 | D. |  与 与  |
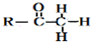 +
+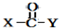 $\stackrel{OH-}{→}$
$\stackrel{OH-}{→}$