题目内容
3.关于丙醇(CH3CH2CH2OH)分子的说法正确的是( )| A. | 分子中共含有11个极性键 | B. | 分子中含有配位键 | ||
| C. | 分子中只含σ键 | D. | 分子中含有1个π键 |
分析 根据丙醇(CH3CH2CH2OH)的结构式可知丙醇分子中含有7个碳氢键、2个碳碳单键,1个碳氧单键以及1个氢氧键.
A.不同非金属元素之间易形成极性共价键;
B.有空轨道的原子和提供孤对电子的原子可形成配位键;
C.只存在共价单键的分子中只含σ键;
D.含有双键、三键的分子中存在σ键和π键.
解答 解:A.根据丙醇(CH3CH2CH2OH)的结构式可知丙醇分子中含有7个碳氢键、2个碳碳单键,1个碳氧单键以及1个氢氧键,所以分子中共含有9个极性键,故A错误;
B.分子中没有空轨道的原子,不含有配位键,故B错误;
C.分子中只含共价单键,只含σ键,故C正确;
D.分子中不含有双键、三键,所以不含π键,故D错误;
故选C.
点评 本题考查化学键类型的判断,题目难度不大,注意极性共价键和非极性共价键的区别.

练习册系列答案
相关题目
13.下列有关物质的表达式正确的是( )
| A. | 乙烯的结构简式:CH2 CH2 | B. | 丙烯的球棍模型: | ||
| C. | 醛基的结构简式:-COH | D. | 羟基的电子式: |
11.下列化学反应的离子方程式正确的是( )
| A. | 往NaOH溶液中通入过量SO2:SO2+2OH-═SO32-+H2O | |
| B. | 锌与稀硝酸反应:Zn+2H+═Zn2++H2↑ | |
| C. | 向氯化铵的溶液中加入足量浓KOH溶液并加热:NH4++OH- $\frac{\underline{\;\;△\;\;}}{\;}$NH3•H2O | |
| D. | 向氯水中通入SO2气体:Cl2+SO2+2H2O═4H++2Cl-+SO42- |
8.下列分子中所有原子都满足最外层8电子结构的是( )
| A. | CH4 | B. | PCl3 | C. | PCl5 | D. | H2O |
15.已知A+、B2+、C-、D2-具有相同的电子层结构,有关A、B、C、D四种元素的叙述中正确的是( )
| A. | 原子序数:B>A>D>C | B. | 原子半径:A>B>C>D | ||
| C. | 金属性:A>B,非金属性:C>D | D. | 离子半径:D2->C->B2+>A+ |
12.在四个不同的容器中进行合成氨的反应.根据下列在相同时间内测定的结果,判断生成氨的速率最快的是( )
| A. | v(H2)=0.3 mol•L-1•min-1 | B. | v(N2)=0.05 mol•L-1•s-1 | ||
| C. | v(N2)=0.2 mol•L-1•min-1 | D. | v(NH3)=0.3 mol•L-1•min-1 |
10.以黄铁矿(主要成分是FeS2)为原料生产硫酸的工艺流程图如下:

(1)若从下列四个城市中选择一处新建一座硫酸厂,你认为厂址宜选在C的郊区(填标号)
A.有丰富黄铁矿资源的城市 B.风光秀丽的旅游城市
C.消耗硫酸甚多的工业城市 D.人口稠密的文化、商业中心城市
(2)沸腾炉中发生反应的化学方程式为4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$ 2Fe2O3+8SO2,接触室中发生反应的化学方程式是2SO2+O2$?_{△}^{催化剂}$ 2SO3.
(3)在硫酸工业制法中,下列生产操作与说明生产操作的主要原因二者都正确的是D.
A.硫铁矿燃烧前要粉碎,因为大块的黄铁矿不能在空气中反应
B.从沸腾炉出来的气体要净化,因为炉气中的SO2会与杂质反应
C.SO2氧化成SO3要用催化剂,这样可提高SO2的转化率
D.SO3用98.3%的浓硫酸来吸收,目的是为了防止形成酸雾,以提髙SO3吸收效率
(4)表是压强对SO2平衡转化率的影响
对于SO2转化SO3的反应,增大压强可使转化率升高,但在实际工业生产中常采用常压条件,理由是常压下转化率已经很高,增加压强可提高转化率,但增加了设备、动力成本等,效益反而下降.
(5)某工厂用500t含硫量为48%的黄铁矿制备硫酸,若在沸腾炉中有2%的FeS2损失,在接触室中SO3的产率为96%,则可得到98%的浓硫酸的质量是376.32tt.

(1)若从下列四个城市中选择一处新建一座硫酸厂,你认为厂址宜选在C的郊区(填标号)
A.有丰富黄铁矿资源的城市 B.风光秀丽的旅游城市
C.消耗硫酸甚多的工业城市 D.人口稠密的文化、商业中心城市
(2)沸腾炉中发生反应的化学方程式为4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$ 2Fe2O3+8SO2,接触室中发生反应的化学方程式是2SO2+O2$?_{△}^{催化剂}$ 2SO3.
(3)在硫酸工业制法中,下列生产操作与说明生产操作的主要原因二者都正确的是D.
A.硫铁矿燃烧前要粉碎,因为大块的黄铁矿不能在空气中反应
B.从沸腾炉出来的气体要净化,因为炉气中的SO2会与杂质反应
C.SO2氧化成SO3要用催化剂,这样可提高SO2的转化率
D.SO3用98.3%的浓硫酸来吸收,目的是为了防止形成酸雾,以提髙SO3吸收效率
(4)表是压强对SO2平衡转化率的影响
| 压强Mpa 转化率% 温度/℃ | 0.1 | 0.5 | 1 | 10 |
| 400 | 99.2 | 99.6 | 99.7 | 99.9 |
(5)某工厂用500t含硫量为48%的黄铁矿制备硫酸,若在沸腾炉中有2%的FeS2损失,在接触室中SO3的产率为96%,则可得到98%的浓硫酸的质量是376.32tt.
 ,系统命名法命名为2,2,4,4-四甲基戊烷
,系统命名法命名为2,2,4,4-四甲基戊烷 ,系统命名法命名为2,2,3,3-四甲基戊烷
,系统命名法命名为2,2,3,3-四甲基戊烷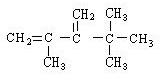 .
.