题目内容
20. 某实验小组以CoCl2•6H2O、过氧化氢、液氨、氯化铵固体为原料,在活性炭催化下,合成了橙黄色晶体X.为确定其组成,他们进行了如下实验:
某实验小组以CoCl2•6H2O、过氧化氢、液氨、氯化铵固体为原料,在活性炭催化下,合成了橙黄色晶体X.为确定其组成,他们进行了如下实验:①氨的测定:精确称取w gX,加适量水溶解,注入下图所示的蒸馏烧瓶中(挟持和加热仪器略去),然后逐滴加入足量10%NaOH溶液,加热烧瓶将氨蒸出,用V1mLc1mol•L-1的盐酸吸收蒸出的氨,然后取下a,用c2 mol•L-1 NaOH标准溶液滴定过剩的HCl,终点时消耗V2 mLNaOH溶液.
②氯的测定:准确称取样品X配成溶液,用K2CrO4溶液为指示剂,在棕色滴定管中用AgNO3标准溶液滴定,至出现砖红色沉淀不再消失为终点(Ag2CrO4为砖红色).
回答下列问题:
(1)X的制备过程中,温度不能过高,其原因是温度过高过氧化氢分解,氨气逸出.
(2)仪器a的名称是锥形瓶;测定氨前应该对装置进行气密性检验,若气密性不好则测定结果将偏低(填“偏高”或“偏低”).
(3)样品中氨的质量分数表达式为$\frac{({C}_{1}{V}_{1}-{C}_{2}{V}_{2})×1{0}^{-3}×17}{W}×100%$.
(4)测定氯的过程中,使用棕色滴定管的原因是防止硝酸银见光分解;滴定终点时,溶液中已检测不到Cl-[c(Cl-)≤1.0×10-5mol•L-1],则出现砖红色沉淀时,溶液中c(CrO42-)的最小值为0.0112mol•L-1.[已知:Ksp(AgCl)=1.0×10-10,Ksp(Ag2CrO4)=1.12×10-12]
(5)经测定分析,样品X中钴、氨和氯的物质的量之比为1:6:3,则制备X的化学方程式为2CoCl2+2NH4Cl+10NH3+H2O2=2[Co(NH3)6]Cl3+2H2O.
(6)某同学向CoCl2溶液中加入足量(NH4)2C2O4得到CoC2O4沉淀,在空气中煅烧CoC2O4生成钴氧化物和CO2,测得充分煅烧后固体质量为2.41g,CO2的体积为1.344L(标准状况),则所得钴氧化物的化学式为Co3O4.
分析 (1)双氧水易分解、气体的溶解度随着温度的升高而降低;
(2)根据仪器a的特征及常见仪器的名称解答;若气密性不好,氨气泄漏,测定结果偏低;
(3)根据氨气与和盐酸反应之间的关系式计算氨气的质量,再根据质量分数公式计算氨质量分数;
(4)硝酸银不稳定,见光易分解;根据离子积常数计算c(CrO42-);
(5)经测定,样品X中钴、氨和氯的物质的量之比为1:6:3,则其化学式为[Co(NH3)6]Cl3,该反应中Co失电子、双氧水得电子,CoCl2、NH4Cl、H2O2、NH3发生反应生成[Co(NH3)6]Cl3和水;
(6)煅烧CoC2O4生成钴氧化物和CO2,测得充分煅烧后固体质量为2.41g,CO2的体积为1.344L(标准状况),根据n(CO2)=$\frac{V}{Vm}$计算二氧化碳的物质的量,根据化学式可知n(Co)=$\frac{1}{2}$n(CO2),根据质量守恒计算出氧元素的物质的量,据此求解化学式.
解答 解:(1)双氧水易分解、气体的溶解度随着温度的升高而降低,氨气逸出,都会造成测量结果不准确,所以X的制备过程中温度不能过高,
故答案为:温度过高过氧化氢分解,氨气逸出;
(2)仪器a为锥形瓶,若气密性不好,导致部分氨气泄漏,所以氨气质量分数偏低,
故答案为:锥形瓶; 偏低;
(3)与氨气反应的n(HCl)=V1×10-3L×C1mol•L-1-C2mol•L-1 ×V2×10-3L=(C1V1-C2V2)×10-3mol,根据氨气和HCl的关系式知,n(NH3)=n(HCl)=(C1V1-C2V2)×10-3mol,氨的质量分数=$\frac{({C}_{1}{V}_{1}-{C}_{2}{V}_{2})×1{0}^{-3}×17}{W}$×100%,
故答案为:$\frac{({C}_{1}{V}_{1}-{C}_{2}{V}_{2})×1{0}^{-3}×17}{W}$×100%;
(4)硝酸银不稳定,见光易分解,为防止硝酸银分解,用棕色滴定管盛放硝酸银溶液,滴定终点时,溶液中已检测不到Cl-,Ksp(AgCl)=1.0×10-10,溶液中c(Cl-)≤1.0×10-5mol•L-1],c(Ag+)≥1.0×10-5 mol•L-1,Ksp(Ag2CrO4)=1.12×10-12,c(CrO42-)=$\frac{{K}_{SP}}{{C}^{2}(A{g}^{+})}$=$\frac{1.12×1{0}^{-12}}{(1×1{0}^{-5})^{2}}$=0.0112mol•L-1,
故答案为:防止硝酸银见光分解;0.0112;
(5)经测定,样品X中钴、氨和氯的物质的量之比为1:6:3,则其化学式为[Co(NH3)6]Cl3,该反应中Co失电子、双氧水得电子,CoCl2、NH4Cl、H2O2、NH3发生反应生成[Co(NH3)6]Cl3和水,反应方程式为2CoCl2+2NH4Cl+10NH3+H2O2=2[Co(NH3)6]Cl3+2H2O;
故答案为:2CoCl2+2NH4Cl+10NH3+H2O2=2[Co(NH3)6]Cl3+2H2O;
(6)煅烧CoC2O4生成钴氧化物和CO2,测得充分煅烧后固体质量为2.41g,CO2的体积为1.344L(标准状况),n(CO2)=$\frac{1.344L}{22.4L/mol}$=0.06mol,由化学式可知n(Co)=0.06mol×$\frac{1}{2}$=0.03mol,则氧化物中n(O)=$\frac{2.41g-0.03mol×59g/mol}{16g/mol}$=0.04mol,则n(Co):n(O)=0.03mol:0.04mol=3:4,所以钴氧化物的化学式为Co3O4,
故答案为:Co3O4.
点评 本题考查了物质含量的测定,涉及难溶物的溶解平衡、氧化还原反应、化学式的计算等知识点,明确实验原理是解本题关键,题目难度中等.

 小学期末标准试卷系列答案
小学期末标准试卷系列答案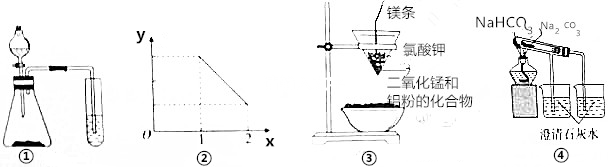
| A. | 用图①装置可比较硫酸、碳酸、硅酸三者的酸性强弱 | |
| B. | 图②表示NO2溶于水完全转化为HNO3时,水(x)与消耗氧气的物质的量(y)之间 关系 | |
| C. | 图③装置可制得金属锰 | |
| D. | 图④装置可验证NaHCO3和NaCO3的热稳定性 |
①化学性质相似的有机物是同系物
②分子组成相差一个或几个CH2的有机物是同系物
③若烃中碳、氢元素的质量分数相同,它们必是同系物
④具有同一通式的物质属于同系物.
| A. | 只有①②③ | B. | 只有①②④ | C. | 只有①③④ | D. | ①②③④ |
| A. | 合成氨工业中,将NH3及时液化分离有利于提高产率 | |
| B. | 工业上通常使用电解法制备金属钠、镁、铝、铁等 | |
| C. | 硫酸工业中,采用常压条件的原因是此条件下催化剂活性最高 | |
| D. | 电解精炼铜时,将粗铜与电源的负极相连 |
| A. | ClO-被还原 | |
| B. | 消耗1mol还原剂,转移3mol电子 | |
| C. | 氧化剂与还原剂的物质的量之比为2:3 | |
| D. | 反应后溶液的酸性明显增强 |
| A. | 石油分馏可获得汽油、煤油等矿物油,煤焦油干馏可获得苯、甲苯等有机物 | |
| B. | 使用“燃煤固硫”、“汽车尾气催化净化”等可减少空气污染 | |
| C. | 汽油、煤油、大豆油中所含主要成分均为烃类 | |
| D. | 硬脂酸甘油酯在碱性条件下的水解属于皂化反应 |


 .
.