题目内容
将Na、Mg、Al各0.3mol分别放入100mL、1mol/L的HCl中,同组同压下产生的气体的体积比是( )
| A、3:1:1 |
| B、6:3:2 |
| C、1:2:3 |
| D、1:1:1 |
考点:氧化还原反应的计算,化学方程式的有关计算
专题:
分析:钠和稀盐酸、水都反应,镁和铝分别与稀盐酸反应方程式为Mg+2HCl=MgCl2+H2↑、2Al+6HCl=2AlCl3+3H2↑,0.3molMg、Al完全反应需要盐酸的物质的量分别是0.6mol、0.9mol,实际上n(HCl)=1mol/L×0.1L=0.1mol,所以镁和铝都剩余.
解答:
解:钠和稀盐酸、水都反应,镁和铝分别与稀盐酸反应方程式为Mg+2HCl=MgCl2+H2↑、2Al+6HCl=2AlCl3+3H2↑,0.3molMg、Al完全反应需要盐酸的物质的量分别是0.6mol、0.9mol,实际上n(HCl)=1mol/L×0.1L=0.1mol,所以镁和铝都剩余,
根据2Na~H2↑可知,0.3molNa完全反应,生成氢气的物质的量=0.3mol×
=0.15mol,
镁和铝都剩余,所以二者与酸反应生成氢气的量相等,生成根据氢原子守恒得生成氢气的量=
=0.05mol,
所以同温同压下产生的气体的物质的量之比=0.15mol:0.05mol:0.05mol=3:1:1,
故选A.
根据2Na~H2↑可知,0.3molNa完全反应,生成氢气的物质的量=0.3mol×
| 1 |
| 2 |
镁和铝都剩余,所以二者与酸反应生成氢气的量相等,生成根据氢原子守恒得生成氢气的量=
| 0.1mol |
| 2 |
所以同温同压下产生的气体的物质的量之比=0.15mol:0.05mol:0.05mol=3:1:1,
故选A.
点评:本题考查氧化还原反应的计算,为高频考点,把握反应中电子守恒为解答的关键,注意Na过量可与水反应生成氢气,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
现将0.5mo1Cu2S与72克FeO投入到足量稀硝酸溶液中,充分反应得到Fe(NO3)3、C(NO3)2、CuSO4的混合溶液,并产生NO气体.则最终反应所得NO物质的量为( )
| A、3.5 mo1 |
| B、2.5 mo1 |
| C、3 mo1 |
| D、2 mo1 |
二氧化硅晶体是立体的网状结构,其结构如图所示.关于二氧化硅晶体的下列说法不正确的是( )
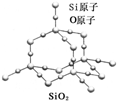

| A、晶体中Si、O原子个数比为1:2 |
| B、晶体中Si、O原子最外层都满足8电子结构 |
| C、晶体中一个硅原子含有Si-O键数目为4 |
| D、晶体中最小环上的原子数为6 |
有些垃圾可以用卫生填埋、焚烧、堆肥等方法处理.下列垃圾中,不适宜用上述方法处理的是( )
| A、果核 | B、电池 |
| C、卫生纸 | D、纯棉纺织品 |
为了保护臭氧层,可采取的有效措施是( )
| A、减少二氧化硫的排放 |
| B、减少含铅废气的排放 |
| C、减少氟氯代烃的排放 |
| D、减少二氧化碳的排放 |
关于如图所示装置的叙述,正确的是( )
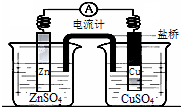

| A、铜是阳极,铜片上有气泡产生 |
| B、盐桥中的阳离子会移向CuSO4溶液 |
| C、正极附近的SO42-离子浓度逐渐增大 |
| D、锌离子在锌片表面被还原 |