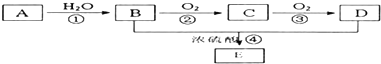
题目内容
在一定温度下,在一体积固定的密闭容器中加入2mol X和1mol Y,发生如下反应:2X(g)+Y(g)?a Z(g)+W(g)△H=-Q kJ?mol-1(Q>0)
当反应达到平衡后,反应放出的热量为Q1 kJ,物质X的转化率为α;平衡后再升高温度,混合气体的平均相对分子质量减小,则
(1)温度升高,平衡常数K的值是 (填“增大”、“减小”或“不变”).
(2)化学计量数a的值为 (a为整数).
(3)有同学认为,Q1一定小于Q,你认为该结论是否正确? (填“是或否”)其理由是 .
(4)维持温度不变,能引起
减小的操作有
A.加入X
B.加入Y
C.增大压强
D.充入He气
(5)X的转化率α= (用含Q、Q1的代数式表示).
当反应达到平衡后,反应放出的热量为Q1 kJ,物质X的转化率为α;平衡后再升高温度,混合气体的平均相对分子质量减小,则
(1)温度升高,平衡常数K的值是
(2)化学计量数a的值为
(3)有同学认为,Q1一定小于Q,你认为该结论是否正确?
(4)维持温度不变,能引起
| c(X) |
| c(W) |
A.加入X
B.加入Y
C.增大压强
D.充入He气
(5)X的转化率α=
考点:化学平衡的影响因素,化学平衡的计算
专题:
分析:(1)分析反应是放热反应,依据平衡移动原理升温,平衡向吸热反应方向进行,平衡逆向进行,平衡常数减小;
(2)题干信息可知平衡后再升高温度,平衡逆向进行,混合气体的平均相对分子质量减小,反应前后气体质量不变,所以气体物质的量增大,2+1>a+1,a<2,化学方程式中系数为整数,则a=1;
(3)焓变的意义是对应反应前后完成的能量变化,在一体积固定的密闭容器中加入2mol X和1mol Y反应是可逆反应达到平衡状态,XY不能完全反应分析;
(4)能够引起
减小,说明c(X)减小或c(W)增大或平衡正向移动;
(5)依据热化学方程式定量关系结合放出热量计算消耗X物质的量,转化率=
×100%;
(2)题干信息可知平衡后再升高温度,平衡逆向进行,混合气体的平均相对分子质量减小,反应前后气体质量不变,所以气体物质的量增大,2+1>a+1,a<2,化学方程式中系数为整数,则a=1;
(3)焓变的意义是对应反应前后完成的能量变化,在一体积固定的密闭容器中加入2mol X和1mol Y反应是可逆反应达到平衡状态,XY不能完全反应分析;
(4)能够引起
| c(X) |
| c(W) |
(5)依据热化学方程式定量关系结合放出热量计算消耗X物质的量,转化率=
| 消耗量 |
| 起始量 |
解答:
解:(1)发生如下反应:2X(g)+Y(g)?aZ(g)+W(g)△H=-Q kJ?mol-1(Q>0),焓变为负值,是放热反应,依据平衡移动原理分析,升温平衡逆向进行,平衡常数减小;
故答案为:减小;
(2)反应放热,若平衡后再升高温度,则平衡向左移动,混合气体的平均相对分子质量减小,说明反应物气体的化学计量数之和大于生成物气体的化学计量数之和,即2+1>a+1,则a=1;
故答案为:1;
(3)2X(g)+Y(g)?aZ(g)+W(g)△H=-Q kJ?mol-1(Q>0),焓变是指2molX,1molY前后完全反应放热QKJ,加入2mol X和1mol Y,反应达到平衡状态,XY不可能完全反应属于放热小于Q;
故答案为:是;2 mol x和1 mol y不可能完全反应;
(4)能够引起
减小,说明c(X)减小或c(W)增大或平衡正向移动;
A、加入X,X浓度增大,故A错误;
B、加入Y,平衡正向移动,故B正确;
C、加压平衡正向移动,故C正确;
D、体积不变充入氦气,平衡不移动,故D错误;
故选BC;
(5)发生反应:2X(g)+Y(g)?aZ(g)+W(g)△H=-Q kJ?mol-1(Q>0),当反应达到平衡后,反应放出的热量为Q1 kJ,消耗X物质的量=
mol,X的转化率=
×100%=
×100%;
故答案为:
×100%.
故答案为:减小;
(2)反应放热,若平衡后再升高温度,则平衡向左移动,混合气体的平均相对分子质量减小,说明反应物气体的化学计量数之和大于生成物气体的化学计量数之和,即2+1>a+1,则a=1;
故答案为:1;
(3)2X(g)+Y(g)?aZ(g)+W(g)△H=-Q kJ?mol-1(Q>0),焓变是指2molX,1molY前后完全反应放热QKJ,加入2mol X和1mol Y,反应达到平衡状态,XY不可能完全反应属于放热小于Q;
故答案为:是;2 mol x和1 mol y不可能完全反应;
(4)能够引起
| c(X) |
| c(W) |
A、加入X,X浓度增大,故A错误;
B、加入Y,平衡正向移动,故B正确;
C、加压平衡正向移动,故C正确;
D、体积不变充入氦气,平衡不移动,故D错误;
故选BC;
(5)发生反应:2X(g)+Y(g)?aZ(g)+W(g)△H=-Q kJ?mol-1(Q>0),当反应达到平衡后,反应放出的热量为Q1 kJ,消耗X物质的量=
| 2Q1 |
| Q |
| ||
| 2mol |
| Q1 |
| Q |
故答案为:
| Q1 |
| Q |
点评:本题考查化学平衡的判断和计算,题目有一定难度,本题易错点为(4).注意一下平衡因素的分析方法和判断依据.

练习册系列答案
相关题目
反应N2(g)+O2(g)=2NO(g),在密闭容器中进行,能加快该反应速率的是( )
| A、扩大体积使压强减小 |
| B、体积不变充入N2使压强增大 |
| C、体积不变充入He使压强增大 |
| D、压强不变充入He |
下列有关实验原理或实验操作不正确的是( )
A、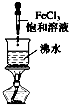 实验室制备氢氧化铁胶体 |
B、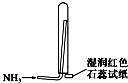 氨气的收集、检验装置 |
C、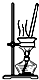 蒸发结晶获得胆矾晶体 |
D、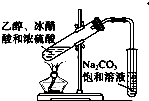 实验室制乙酸乙酯 |
某温度下,将1molNH3充入恒容密闭容器A中,当反应达到平衡时,NH3的体积分数为x%.在相同条件下,向该容器充入2molNH3,当反应达到平衡时,NH3的体积分数为y%,则x、y大小关系为是( )
| A、x>y | B、x=y |
| C、x<y | D、x≥y |
将Na、Mg、Al各0.3mol分别放入100mL、1mol/L的HCl中,同组同压下产生的气体的体积比是( )
| A、3:1:1 |
| B、6:3:2 |
| C、1:2:3 |
| D、1:1:1 |