题目内容
19.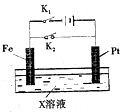 如图是一个电化学过程的示意图,请回答下列问题:
如图是一个电化学过程的示意图,请回答下列问题:(1)X为CuSO4溶液
①若断开K1,闭合K2,Pt为正极(填“正”、“负”、“阴”、“阳”中的一个,下同),该极发生的电极反应式Cu2++2e-=Cu.
②若断开K2,闭合K1,Pt为阳极,该极发生的电极反应式4OH--4e-=O2↑+2H2O,Fe电极上的现象是红色物质生成.
(2)X为滴有少量酚酞的NaCl溶液
①若断开K1,闭合K2,Pt电极附近现象溶液变红,铁能否被腐蚀能?(填“能”或“否”).若能被腐蚀,该腐蚀属于吸氧腐蚀.
①若断开K2,闭合K1,此时该池中总反应的离子方程式2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH-,该条件下若导线中转移0.02mole-后就断开K1,此时溶液体积为200mL,则溶液混合均匀后的pH=13.
分析 (1)①若断开K1,闭合K2,是原电池装置,所以不活泼的Pt为正极,该铜离子放电生成铜单质;
②若断开K2,闭合K1,Pt与电源的正极相连,所以Pt为阳极,电极反应式为:4OH--4e-=O2↑+2H2O;Fe电极是阴极,电极上的铜离子放电,生成单质铜;
(2)①若断开K1,闭合K2,是原电池装置,所以不活泼的Pt为正极,发生吸氧腐蚀,正极的电极反应式为:O2+4e-+2H2O=4OH-,负极:Fe-2e-=Fe2+,由此解答;
②电解氯化钠溶液的方程式为:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2NaOH,离子方程式为:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH-,乙池转移0.02mole-后,会生成0.02mol的氢氧化钠,所以所得NaOH溶液的物质的量浓度c=$\frac{n}{V}$=$\frac{0.02mol}{0.2L}$=0.1mol/L,根据水的离子积进行计算.
解答 解:(1)①若断开K1,闭合K2,是原电池装置,所以不活泼的Pt为正极,该铜离子放电生成铜单质,所以电极反应式为:Cu2++2e-=Cu,故答案为:正;Cu2++2e-=Cu;
②若断开K2,闭合K1,Pt与电源的正极相连,所以Pt为阳极,电极反应式为:4OH--4e-=O2↑+2H2O;Fe电极是阴极,电极上的铜离子放电,生成单质铜,所以观察有红色物质生成,故答案为:阳;4OH--4e-=O2↑+2H2O;红色物质生成;
(2)①若断开K1,闭合K2,是原电池装置,所以不活泼的Pt为正极,发生吸氧腐蚀,正极的电极反应式为:O2+4e-+2H2O=4OH-,所以溶液变红,负极:Fe-2e-=Fe2+,故答案为:溶液变红;能;吸氧;
②电解氯化钠溶液的方程式为:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2NaOH,离子方程式为:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH-,乙池转移0.02mole-后,会生成0.02mol的氢氧化钠,所以所得NaOH溶液的物质的量浓度c=$\frac{n}{V}$=$\frac{0.02mol}{0.2L}$=0.1mol/L,所以溶液中氢离子浓度=$\frac{1{0}^{-14}}{0.1}$,所以溶液的pH=13,
故答案为:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH-;13.
点评 本题考查原电池和电解原理,明确工作原理及发生的电极反应是解答的关键,注意电极的判断和电子守恒的应用,题目难度中等.

| A. | 通直流电后,溶液中溶质分子分别向两极移动,而胶体中分散质粒子向某一极移动 | |
| B. | 向Fe(OH)3胶体中不断滴加稀硫酸,最终胶体聚沉产生红褐色沉淀 | |
| C. | 硫酸铜溶液通过一束光无特殊现象,淀粉溶液中通过一束光侧面出现一条光亮的通路 | |
| D. | 溶液中溶质粒子的运动有规律,胶体粒子运动无规则 |
| A. | 乙炔分子的比例模型示意图: | B. | 2-甲基-2-戊烯的键线式: | ||
| C. | 乙醇的结构简式:CH3CH2OH | D. | 1,3-丁二烯的分子式:C4H8 |
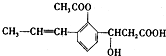 ,下列有关该有机化合物的说法不正确的是
,下列有关该有机化合物的说法不正确的是( )
| A. | 含有四种官能团 | |
| B. | 能发生取代、加成、消去、氧化等反应• | |
| C. | 1mol该有机物最多可以与2molNaOH反应 | |
| D. | 该有机物属于芳香族化合物 |
 在t℃时,AgCl在水中的沉淀溶解平衡曲线如图所示(假设AgCl饱和溶液的密度与水的密度近似相等).下列说法错误的是( )
在t℃时,AgCl在水中的沉淀溶解平衡曲线如图所示(假设AgCl饱和溶液的密度与水的密度近似相等).下列说法错误的是( )| A. | 在t℃时,AgCL的Ksp为4×10-10 | |
| B. | 在t℃时,c点溶液中一定有AgCl沉淀析出 | |
| C. | 在t℃时,AgCl的溶解度约为2.9×10-4g | |
| D. | d点溶液,温度升高后c(Ag+)、c(Cl-)均不变 |
| A. | 使无色酚酞试液呈红色的溶液中:Na+、K+、SO42-、CO32- | |
| B. | 无色透明的溶液中:Cu2+、K+、SO42-、NO3- | |
| C. | 含有大量Ba(NO3)2的溶液中:Mg2+、NH4+、SO42-、Cl- | |
| D. | 使紫色石蕊试液呈红色的溶液中:Na+、K+、CO32-、NO3- |
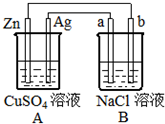 如图所示的装置中电极a、b均为碳棒,两烧杯中所盛溶液均为500mL 1.0mol/L.
如图所示的装置中电极a、b均为碳棒,两烧杯中所盛溶液均为500mL 1.0mol/L.