题目内容
10.下列反应中,属于取代反应的是( )| A. | CH3CH=CH2+Br2$\stackrel{CCl_{4}}{→}$CH3CHBrCH2Br | |
| B. | CH3CH2OH $→_{170℃}^{浓H_{2}SO_{4}}$ CH2=CH2↑+H2O | |
| C. | CH3COOH+CH3CH2OH $→_{△}^{浓H_{2}SO_{4}}$ CH3COOCH2CH3+H2O | |
| D. | 2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O |
分析 根据取代反应的定义“有机化合物分子里的某些原子或原子团被其它原子或原子团所代替的反应”进行判断.
解答 解:A.CH3CH=CH2+Br2$\stackrel{CCl_{4}}{→}$CH3CHBrCH2Br为加成反应,故A错误;
B.CH3CH2OH $→_{170℃}^{浓H_{2}SO_{4}}$ CH2=CH2↑+H2O,为消去反应,故B错误;
C.CH3COOH+CH3CH2OH $→_{△}^{浓H_{2}SO_{4}}$ CH3COOCH2CH3+H2O,为酯化反应,也是取代反应,故C正确;
D.2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O为氧化反应,故D错误.
故选C.
点评 本题考查了取代反应、加成反应、消去反应和酯化反应的判断,难度不大,正确理解概念是解本题的关键.

练习册系列答案
 优学名师名题系列答案
优学名师名题系列答案
相关题目
20.下列实验操作或装置(略去部分夹持仪器)正确的是( )
| A. |  配制溶液 | B. |  中和滴定 | ||
| C. |  测定中和反应的反应热 | D. |  构成铜锌原电池 |
1.下表为元素周期表的一部分,参照元素①~⑦在表中的位置,请用化学用语回答下列问题:
(1)⑥的最低负价是-2;⑦的最高价含氧酸的化学式为HClO4.
(2)③、④、⑦的简单离子半径由大到小的顺序为Cl->F->Na+用离子符号表示).
(3)⑦的单质电子式为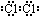 ,由②、④两种元素的原子按1:1组成化合物的电子式为
,由②、④两种元素的原子按1:1组成化合物的电子式为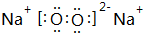 .
.
(4)②、⑥的单质中更易与①的单质反应的是氧气,用原子结构的理论解释原因是同一主族从上到下,原子半径增大,得电子能力减弱,元素的非金属减弱,所以氧气的氧化性比硫强.
(5)④、⑤的最高价氧化物对应水化物之间发生反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O.
(6)若用①、②的单质和④的最高价氧化物对应水化物的溶液设计成化学电源,则该电池负极的电极反应式为H2+2OH--2e-=2H2O正极的电极反应式为O2+2H2O+4e-=4OH-.
| 族 周期 | IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ||||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ||||
(2)③、④、⑦的简单离子半径由大到小的顺序为Cl->F->Na+用离子符号表示).
(3)⑦的单质电子式为
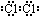 ,由②、④两种元素的原子按1:1组成化合物的电子式为
,由②、④两种元素的原子按1:1组成化合物的电子式为 .
.(4)②、⑥的单质中更易与①的单质反应的是氧气,用原子结构的理论解释原因是同一主族从上到下,原子半径增大,得电子能力减弱,元素的非金属减弱,所以氧气的氧化性比硫强.
(5)④、⑤的最高价氧化物对应水化物之间发生反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O.
(6)若用①、②的单质和④的最高价氧化物对应水化物的溶液设计成化学电源,则该电池负极的电极反应式为H2+2OH--2e-=2H2O正极的电极反应式为O2+2H2O+4e-=4OH-.
18.不能用胶体的知识解释的现象是( )
| A. | 清晨的阳光穿过茂密的林木枝叶所产生的美丽景象(美丽的光线) | |
| B. | 静电除尘 | |
| C. | 在海水与河水交界处,易形成三角洲 | |
| D. | 向FeCl3溶液中加入NaOH溶液,会出现红褐色 |
5.某化学兴趣小组拟用粗氧化铜(含少量铜粉、氧化铁及不溶于酸的杂质)制取无水氯化铜,其制备步骤如下

实验过程中所用的物质x,y及pH控制参照下表确定:表I
表Ⅱ
请填写下列空白
(1)沉淀Ⅱ的成分(化学式)是Fe(OH)3.
(2)步骤②加入的试剂x可选用表Ⅱ中的AC (填序号,且选出全部合理的),其作用是将亚铁离子转化为铁离子
(3)步骤③加入的试剂y可选用表Ⅱ中的FG(填序号,且选出全部合理的),控制pH=5的目的是将铁离子转化为沉淀而铜离子不产生沉淀
(4)步骤⑤要得到无水CuCl2,应控制的一定条件是在干燥的HCl气流中加热CuCl2•2H2O.
(5)步骤①中所发生的全部反应的离子方程式:CuO+2H+=Cu2++H2O、Fe2O3+6H+=2Fe3++3H2O、Cu+2Fe3+=Cu2++2Fe2+.

实验过程中所用的物质x,y及pH控制参照下表确定:表I
| 物质 | 开始沉淀时pH | 完全沉淀时pH |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| Cu(OH)2 | 5.2 | 6.4 |
| 氧化剂 | 调节pH的物质 | ||
| A | 双氧水 | E | 氨水 |
| B | 高锰酸钾 | F | 碱式碳酸铜 |
| C | 氯水 | G | 氧化铜 |
(1)沉淀Ⅱ的成分(化学式)是Fe(OH)3.
(2)步骤②加入的试剂x可选用表Ⅱ中的AC (填序号,且选出全部合理的),其作用是将亚铁离子转化为铁离子
(3)步骤③加入的试剂y可选用表Ⅱ中的FG(填序号,且选出全部合理的),控制pH=5的目的是将铁离子转化为沉淀而铜离子不产生沉淀
(4)步骤⑤要得到无水CuCl2,应控制的一定条件是在干燥的HCl气流中加热CuCl2•2H2O.
(5)步骤①中所发生的全部反应的离子方程式:CuO+2H+=Cu2++H2O、Fe2O3+6H+=2Fe3++3H2O、Cu+2Fe3+=Cu2++2Fe2+.
15. 我国科研人员以蹄叶囊青为原料先制得化合物Ⅰ再转化为具有抗癌抑菌活性的倍半萜化合物Ⅱ,有关转化如图所示,下列有关说法不正确的是( )
我国科研人员以蹄叶囊青为原料先制得化合物Ⅰ再转化为具有抗癌抑菌活性的倍半萜化合物Ⅱ,有关转化如图所示,下列有关说法不正确的是( )
 我国科研人员以蹄叶囊青为原料先制得化合物Ⅰ再转化为具有抗癌抑菌活性的倍半萜化合物Ⅱ,有关转化如图所示,下列有关说法不正确的是( )
我国科研人员以蹄叶囊青为原料先制得化合物Ⅰ再转化为具有抗癌抑菌活性的倍半萜化合物Ⅱ,有关转化如图所示,下列有关说法不正确的是( )| A. | 化合物Ⅰ能使酸性KMnO4溶液褪色 | |
| B. | 化合物Ⅰ分子中含有6个手性碳原子 | |
| C. | 化合物Ⅱ一定条件下能发生取代、消去及加成反应 | |
| D. | 检验化合物Ⅱ中是否含化合物Ⅰ可用Br2的CCl4溶液 |
2.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 0.1 mol•L-1MgCl2溶液中含有的Mg2+数目一定小于0.1NA | |
| B. | 标准状况下,11.2 L CCl4中含有的分子数目为0.5NA | |
| C. | 4.6g由NO2和N2O4组成的混合物中含有氧原子的数目为0.2 NA | |
| D. | 1 mol CH5+中含有的电子数目为11NA |
19.肼(N2H4)常用作火箭发动机的燃料,NO2为氧化剂,反应生N2和水蒸气.
已知:N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-534kJ•mol-1,N2(g)+2O2(g)═2NO2(g)
△H=+67.7kJ•mol-1.下列关于气态肼和NO2气体反应的热化学方程式中,正确的是( )
已知:N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-534kJ•mol-1,N2(g)+2O2(g)═2NO2(g)
△H=+67.7kJ•mol-1.下列关于气态肼和NO2气体反应的热化学方程式中,正确的是( )
| A. | 2N2H4(g)+2NO2(g)═3N2(g)+4H2O(l)△H=-1135.7 kJ•mol-1 | |
| B. | 2N2H4(g)+2NO2(g)═3N2(g)+4H2O(g)△H=-1000.3 kJ•mol-1 | |
| C. | N2H4(g)+NO2(g)═$\frac{3}{2}$N2(g)+2H2O(l)△H=-1135.7 kJ•mol-1 | |
| D. | 2N2H4(g)+2NO2(g)═3N2(g)+4H2O(g)△H=-1135.7 kJ•mol |
