题目内容
12.下列有关化学用语表示正确的是( )| A. | 甲醇的结构式:CH4O | |
| B. | 钠离子的结构示意图: | |
| C. | 质子数为16、中子数为17的硫原子:${\;}_{16}^{17}$S | |
| D. | 硫化氢分子的电子式: |
分析 A.CH4O为甲醇的分子式,结构式中需要用短线表示出所有的共价键;
B.钠离子的核电荷数为11,核外电子总数为10;
C.质量数=质子数+中子数,元素符号的左上角为质量数;
D.硫化氢为共价化合物,分子中不存在阴阳离子.
解答 解:A.甲醇可以看作羟基取代了甲烷中的1个H原子,甲醇的结构式为: ,故A错误;
,故A错误;
B.钠离子最外层达到8电子稳定结构,其离子结构示意图为: ,故B正确;
,故B正确;
C.质子数为16、中子数为17的硫原子的质量数为33,该原子正确的表示方法为:3316S,故C错误;
D.硫化氢属于共价化合物,电子式中不能标出电荷,其正确的电子式为 ,故D错误;
,故D错误;
故选B.
点评 本题考查了常见化学用语的表示方法,题目难度不大,涉及电子式、结构简式、离子结构示意图、元素符号等知识,明确常见化学用语的书写原则为解答关键,试题培养了学生的灵活应用能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
2.某温度下,将Cl2通入NaOH溶液中,反应得到NaCl、NaClO、NaClO3的混合液,经测定ClO-与ClO3-的浓度之比为1:5,则Cl2与NaOH溶液反应时被氧化的氯原子与被还原的氯原子的物质的量之比为( )
| A. | 1:1 | B. | 5:1 | C. | 3:13 | D. | 4:15 |
3.下列有关电解质溶液的说法正确的是( )
| A. | 向盐酸中加入氨水至中性,溶液中$\frac{c(N{H}_{4}^{+})}{c(C{l}^{-})}$<1 | |
| B. | 向AgCl、AgBr的饱和溶液中加入少量AgNO3,溶液中$\frac{c(C{l}^{-})}{c(B{r}^{-})}$变大 | |
| C. | 将CH3COONa溶液加入水稀释后,溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)•c(O{H}^{-})}$不变 | |
| D. | 向0.1 mol•L-1 CH3COOH溶液从20℃升温至30℃,溶液中$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$减小 |
7.下列溶液加热蒸干后,能析出溶质固体的是( )
| A. | AlCl3 | B. | Fe2(SO4)3 | C. | KHCO3 | D. | NH4HCO3 |
17.下列图示与对应的叙述相符的是( )
| A. | 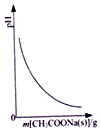 图表示向CH3COOH溶液中逐步加入CH3COONa固体后,溶液pH的变化 | |
| B. | 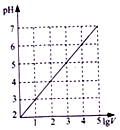 图表示0.1LpH=2的HC1溶液加水稀释至VL,pH随lgV的变化 | |
| C. | 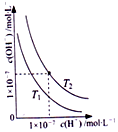 图表示不同温度下水溶液中H+和OH-浓度变化的曲线,图中温度T2>T1 | |
| D. | 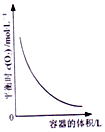 图表示同一温度下,再不同容积的容器中进行反应2BaO2(s)?2BaO(S)+O2(g),O2的平衡浓度与容器容积的关系 |
4.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 2.3g钠与水反应产生组气的分子数为0.05NA | |
| B. | 28gN2和N4组成的混合气体中含有的原子数为3NA | |
| C. | 0.1 mol•L-1Na2SO4溶液含有0.1NA个SO42- | |
| D. | 22.4L氯气中含有的电子总数一定为34NA |
1.用NA表示阿伏加德罗常数的值.下列说法正确的是( )
| A. | 1 mol NO中含有的原子数目为2NA | |
| B. | 常温下,22.4L氮气含有的原子数目为2NA | |
| C. | 1L1 mol L-1 MgS04溶液中含有的Mg2+数目为2NA | |
| D. | 2.8 g硅单质与足量氧气在高温下完全反应时,硅原子失去的电子数目为2NA |
 A、B、C、D、E五种物质中含有同一种元素,其相互转化关系如图所示.
A、B、C、D、E五种物质中含有同一种元素,其相互转化关系如图所示.