题目内容
将4mol A 气体和2mol B气体置于1L的密闭容器中,混合后发生如下反应:2A(g)+B(g)═2C(g),若经2s后测得C的浓度为1.2mol/L,下列说法正确的是( )
| A、用物质A表示的反应速率为1.2 mol/(L?s) |
| B、2 s时物质A的转化率为30% |
| C、用物质B表示的反应速率为0.6 mol/(L?s) |
| D、2 s时物质B的浓度为0.6 mol/L |
考点:化学平衡的计算
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.先根据v=
计算C的反应速率,同一可逆反应中同一时间段内各物质的反应速率之比等于其计量数之比,据此计算A的平均反应速率;
B.先计算2s后C的物质的量,再根据A、C之间的关系式计算参加反应的A的物质的量,最后根据转化率公式计算A的转化率;
C.先根据v=
计算C的反应速率,同一可逆反应中同一时间段内各物质的反应速率之比等于其计量数之比,据此计算B的平均反应速率;
D.根据C和B之间的关系式计算参加反应的B的物质的量,再根据C=
计算2s时B的物质的量浓度.
| △C |
| △t |
B.先计算2s后C的物质的量,再根据A、C之间的关系式计算参加反应的A的物质的量,最后根据转化率公式计算A的转化率;
C.先根据v=
| △C |
| △t |
D.根据C和B之间的关系式计算参加反应的B的物质的量,再根据C=
| n |
| V |
解答:
解:A.2s内C的平均反应速率=
mol/(L.s)=0.6mol/(L.s),同一可逆反应中同一时间段内各物质的反应速率之比等于其计量数之比,则v(A)=v(C)=0.6mol/(L.s),故A错误;
B.2s后n(C)=1.2mol/L×1L=1.2mol,参加反应的n(A)=n(C)=1.2mol,则A的转化率=
×100%=30%,故B正确;
C.根据A知,2s内C的平均反应速率为0.6mol/(L.s),同一可逆反应中同一时间段内各物质的反应速率之比等于其计量数之比,则v(B)=
v(C)=
×0.6mol/(L.s)=0.3mol/(L?s),故C错误;
D.2s后n(C)=1.2mol/L×1L=1.2mol,参加反应的n(B)=
n(C)=
×1.2mol=0.6mol,2s时B的浓度=
mol/L=1.4mol/L,故D错误;
故选B.
| 1.2-0 |
| 2 |
B.2s后n(C)=1.2mol/L×1L=1.2mol,参加反应的n(A)=n(C)=1.2mol,则A的转化率=
| 1.2mol |
| 4mol |
C.根据A知,2s内C的平均反应速率为0.6mol/(L.s),同一可逆反应中同一时间段内各物质的反应速率之比等于其计量数之比,则v(B)=
| 1 |
| 2 |
| 1 |
| 2 |
D.2s后n(C)=1.2mol/L×1L=1.2mol,参加反应的n(B)=
| 1 |
| 2 |
| 1 |
| 2 |
| 2-0.6 |
| 1 |
故选B.
点评:本题考查反应速率的相关计算,侧重考查学生对基本概念、物质之间的关系等知识点的理解和掌握,同时考查学生计算能力,题目难度不大.

练习册系列答案
 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案
相关题目
己烯雌酚是一种激素类药物,结构如下列叙述中正确的是( )
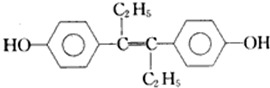

| A、该有机物分子中,最多可能有18个碳原子共平面 |
| B、该分子中有7个碳碳双键,可以与氢气1:7加成 |
| C、该分子对称性好,所以没有顺反异构 |
| D、标况下,1mol该有机物与足量金属钠反应可以放出22.4L的氢气 |
只用试管和胶头滴管,不用其它试剂无法区分的一组溶液是( )
| A、KOH溶液和AlCl3溶液 |
| B、Na2CO3溶液和盐酸 |
| C、NaHCO3溶液和NaOH溶液 |
| D、盐酸和NaAlO2溶液 |
T℃时,CaCO3和CaF2的Ksp分别为1.0×10-10和4.0×10-12.下列说法正确的是( )
| A、T℃时,两饱和溶液中c(Ca2+ ):CaCO3>CaF2 |
| B、T℃时,两饱和溶液等体积混合,会析出CaF2固体 |
| C、T℃时,CaF2固体在稀盐酸中的Ksp比在纯水中的Ksp大 |
| D、T℃时,向CaCO3悬浊液中加NaF固体,可能析出CaF2固体 |
一定温度下,体积为2L的密闭容器中X、Y、Z三种气体的初始物质的量和平衡物质的量如表:下列说法正确的是( )
| 物质 | X | Y | Z |
| 初始物质的量(mol) | 0.2 | 0.2 | 0 |
| 平衡物质的量(mol) | 0.1 | 0.05 | 0.1 |
| A、反应可表示为2X+3Y?2Z,其平衡常数为8000 |
| B、增大压强使平衡向生成Z的方向移动,平衡常数增大 |
| C、若将容器的体积压缩至1L,则X的体积分数减小,浓度增大 |
| D、若升高温度时,Z的浓度增大,可知温度升高时正反应速率增大,逆反应速率减小,平衡朝正反应方向移动 |