题目内容
为了除去粗盐中的Ca2+,Mg2+,SO42-及泥沙,得到纯净的NaCl,可将粗盐溶于水,然后在下列操作中选取必要的步骤和正确的操作顺序
①过滤;②加过量NaOH溶液;③加适量盐酸;④加过量Na2CO3溶液;⑤加过量BaCl2溶液
A.④②⑤B.④①②⑤③C.②⑤④①③D.①④②⑤③
写出有关反应的化学方程式6个:(杂质可理解为MgCl2,CaCl2,Na2SO4) , , , , , .
①过滤;②加过量NaOH溶液;③加适量盐酸;④加过量Na2CO3溶液;⑤加过量BaCl2溶液
A.④②⑤B.④①②⑤③C.②⑤④①③D.①④②⑤③
写出有关反应的化学方程式6个:(杂质可理解为MgCl2,CaCl2,Na2SO4)
考点:粗盐提纯
专题:化学实验基本操作
分析:根据镁离子用氢氧根离子沉淀,硫酸根离子用钡离子沉淀,钙离子用碳酸根离子沉淀,过滤要放在所有的沉淀操作之后,加碳酸钠要放在加氯化钡之后,可以将过量的钡离子沉淀最后再用盐酸处理溶液中的碳酸根离子和氢氧根离子进行分析,依据除杂试剂的作用写出化学方程式.
解答:
解:镁离子用氢氧根离子沉淀,加入过量的氢氧化钠可以将镁离子沉淀,硫酸根离子用钡离子沉淀,加入过量的氯化钡可以将硫酸根离子沉淀,至于先除镁离子,还是先除硫酸根离子都行,钙离子用碳酸根离子沉淀,除钙离子加入碳酸钠转化为沉淀,但是加入的碳酸钠要放在加入的氯化钡之后,这样碳酸钠会除去反应剩余的氯化钡,离子都沉淀了,在进行过滤,最后再加入盐酸除去反应剩余的氢氧根离子和碳酸根离子,所以正确的顺序为:②加过量的氢氧化钠溶液; ⑤加过量的氯化钡溶液; ④加过量的碳酸钠溶液; ①过滤; ③加适量盐酸.
故选C;
加入过量的BaCl2溶液,除去Na2SO4:BaCl2+Na2SO4=BaSO4↓+2NaCl
加入过量的NaOH溶液,除去MgCl2:MgCl2+2NaOH=Mg(OH)2↓+2NaCl
加入过量的Na2CO3溶液,除去CaCl2和BaCl2(两个反应方程式):Na2CO3+CaCl2=CaCO3↓+2NaCl Na2CO3+BaCl2=BaCO3↓+2NaCl
过滤
最后滴加适量盐酸至恰好不再产生气体,除去NaOH和Na2CO3:HCl+NaOH=NaCl+H2O、2HCl+Na2CO3=2NaCl+H2O+CO2↑蒸发溶液,析出NaCl晶体,
故答案为:BaCl2+Na2SO4=BaSO4↓+2NaCl;MgCl2+2NaOH=Mg(OH)2↓+2NaCl;Na2CO3+CaCl2=CaCO3↓+2NaCl;Na2CO3+BaCl2=BaCO3↓+2NaCl;HCl+NaOH=NaCl+H2O;2HCl+Na2CO3=2NaCl+H2O+CO2↑.
故选C;
加入过量的BaCl2溶液,除去Na2SO4:BaCl2+Na2SO4=BaSO4↓+2NaCl
加入过量的NaOH溶液,除去MgCl2:MgCl2+2NaOH=Mg(OH)2↓+2NaCl
加入过量的Na2CO3溶液,除去CaCl2和BaCl2(两个反应方程式):Na2CO3+CaCl2=CaCO3↓+2NaCl Na2CO3+BaCl2=BaCO3↓+2NaCl
过滤
最后滴加适量盐酸至恰好不再产生气体,除去NaOH和Na2CO3:HCl+NaOH=NaCl+H2O、2HCl+Na2CO3=2NaCl+H2O+CO2↑蒸发溶液,析出NaCl晶体,
故答案为:BaCl2+Na2SO4=BaSO4↓+2NaCl;MgCl2+2NaOH=Mg(OH)2↓+2NaCl;Na2CO3+CaCl2=CaCO3↓+2NaCl;Na2CO3+BaCl2=BaCO3↓+2NaCl;HCl+NaOH=NaCl+H2O;2HCl+Na2CO3=2NaCl+H2O+CO2↑.
点评:本题主要考查了在粗盐提纯中的物质的除杂或净化操作,在解此类题时,首先要了解需要除去的是哪些离子,然后选择适当的试剂进行除杂,在除杂质时,要注意加入试剂的量的控制.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
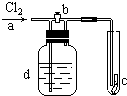 如图,a处通入Cl2,当打开b阀时,c处的干燥的红布条没有明显变化,当关闭b阀时,c处的干燥红布条逐渐褪色,则d瓶中装的溶液可能是( )
如图,a处通入Cl2,当打开b阀时,c处的干燥的红布条没有明显变化,当关闭b阀时,c处的干燥红布条逐渐褪色,则d瓶中装的溶液可能是( )| A、NaOH溶液 |
| B、浓H2SO4 |
| C、Ca(OH)2溶液 |
| D、食盐水 |
 如图所示是某化学小组根据教材知识设计,说明Na2CO3与NaHCO3热稳定性的套管实验.下列叙述中不正确的是( )
如图所示是某化学小组根据教材知识设计,说明Na2CO3与NaHCO3热稳定性的套管实验.下列叙述中不正确的是( )| A、甲为NaHCO3,乙为Na2CO3 |
| B、要证明NaHCO3受热能产生水,可在小试管内放置沾有少量无水硫酸铜粉末的棉花球 |
| C、加热不久就能看到A烧杯中的澄清石灰水变浑浊 |
| D、整个实验过程中A烧杯中的澄清石灰水无明显变化 |
配制一定物质的量浓度的溶液,所需使用的一组仪器是( )
| A、集气瓶、水槽、药匙、量筒、玻璃棒 |
| B、托盘天平、大试管、玻璃棒、胶头滴管 |
| C、烧杯、容量瓶、玻璃棒、量筒、胶头滴管 |
| D、烧瓶、量筒、胶头滴管、玻璃棒、烧杯 |
下列对沉淀溶解平衡的描述不正确的是( )
| A、用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl小 |
| B、物质的溶解度随温度的升高而增加,故物质的溶解都是吸热的 |
| C、除去溶液中的Mg2+,用OH-沉淀Mg2+比用CO32-效果好,说明Mg(OH)2的溶解度比MgCO3大 |
| D、沉淀反应中常加过量的沉淀剂,其目的是使沉淀完全 |
将4mol A 气体和2mol B气体置于1L的密闭容器中,混合后发生如下反应:2A(g)+B(g)═2C(g),若经2s后测得C的浓度为1.2mol/L,下列说法正确的是( )
| A、用物质A表示的反应速率为1.2 mol/(L?s) |
| B、2 s时物质A的转化率为30% |
| C、用物质B表示的反应速率为0.6 mol/(L?s) |
| D、2 s时物质B的浓度为0.6 mol/L |
下列说法中正确的是( )
| A、增大反应物浓度,可逆反应正速率增大;减少反应物浓度,可逆反应逆速率增大 |
| B、粗铜精炼时,电解质液中的c(Cu2+)保持不变 |
| C、纯银在空气中久置变黑发生的是电化学腐蚀 |
| D、阴极电保护法是将被保护的金属与外加电源的负极相连 |
在相同的温度下,100mL 0.01mol?L-1醋酸溶液与10mL 0.1mol?L-1醋酸溶液相比较,下列数值中前者大于后者的是( )
| A、中和时所需氢氧化钠的物质的量 |
| B、H+的物质的量浓度 |
| C、电离平衡常数K |
| D、H+的物质的量 |
下列有关叙述不正确的是( )
| A、等浓度的NaCN、NaHSO3混合溶液中:c(HCN)+c(CN-)=c(HSO3-)+c(H2SO3) |
| B、pH=4.5的食醋中c(H+)是pH=6.5的番茄汁中c(H+)的100倍 |
| C、10mlpH=2的HA溶液、HB溶液分别与足量的锌反应,HA溶液放出的氢气较多,说明HA的酸性比HB的弱 |
| D、pH=4.5的CH3COOH与CH3COONa混合溶液中:c(Na+)<c(CH3COO-) |