题目内容
只用试管和胶头滴管,不用其它试剂无法区分的一组溶液是( )
| A、KOH溶液和AlCl3溶液 |
| B、Na2CO3溶液和盐酸 |
| C、NaHCO3溶液和NaOH溶液 |
| D、盐酸和NaAlO2溶液 |
考点:物质的检验和鉴别的实验方案设计
专题:物质检验鉴别题
分析:只用试管和胶头滴管而不用其它试剂就能区分,说明反应现象与反应物的量有关,结合物质间的反应来分析解答.
解答:
解:A.当AlCl3溶液过量时,反应离子方程式为:Al3++3OH-=Al(OH)3↓,当氯化铝少量时,离子反应方程式为Al3++4OH-=AlO2-+2H2O,所以反应现象不同,故A不选;
B.当盐酸少量时,离子反应方程式为CO32-+H+=HCO3-,当盐酸过量时,离子反应方程式为2H++CO32-=CO2↑+H2O,所以反应现象不同,故B不选;
C.无论NaOH是否过量,离子反应方程式均为HCO3-+OH-=CO32-+H2O,现象相同,不能鉴别,故C选;
D.当盐酸少量时,离子反应方程式为H++AlO2-+H2O=Al(OH)3↓,当盐酸过量时,离子反应方程式为:4H++AlO2-=Al3++2H2O,所以反应现象不同,故D不选;
故选C.
B.当盐酸少量时,离子反应方程式为CO32-+H+=HCO3-,当盐酸过量时,离子反应方程式为2H++CO32-=CO2↑+H2O,所以反应现象不同,故B不选;
C.无论NaOH是否过量,离子反应方程式均为HCO3-+OH-=CO32-+H2O,现象相同,不能鉴别,故C选;
D.当盐酸少量时,离子反应方程式为H++AlO2-+H2O=Al(OH)3↓,当盐酸过量时,离子反应方程式为:4H++AlO2-=Al3++2H2O,所以反应现象不同,故D不选;
故选C.
点评:本题考查物质的鉴别,为高频考点,注意利用反应的不同现象来区分是解答的关键,侧重与量有关的离子反应的考查,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列关于Na2O与Na2O2的说法中,不正确的是( )
| A、Na2O2具有漂白性 |
| B、均与水反应生成NaOH,因而均是碱性氧化物 |
| C、Na2O中氧-2价,Na2O2中氧-1价 |
| D、均可与H2O、CO2反应 |
配制一定物质的量浓度的溶液,所需使用的一组仪器是( )
| A、集气瓶、水槽、药匙、量筒、玻璃棒 |
| B、托盘天平、大试管、玻璃棒、胶头滴管 |
| C、烧杯、容量瓶、玻璃棒、量筒、胶头滴管 |
| D、烧瓶、量筒、胶头滴管、玻璃棒、烧杯 |
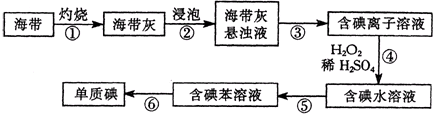
海洋中有丰富的食品、矿产、能源和药物.如图是从海水中提取某些原料的流程图.下列有关说法正确的是( )


| A、从海水中提取物质都必须通过化学反应才能实现 |
| B、第②步属于物理变化 |
| C、从第④~⑤步的目的是浓缩、富集溴单质 |
| D、第①步中除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+等杂质,加入试剂的顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸 |
将4mol A 气体和2mol B气体置于1L的密闭容器中,混合后发生如下反应:2A(g)+B(g)═2C(g),若经2s后测得C的浓度为1.2mol/L,下列说法正确的是( )
| A、用物质A表示的反应速率为1.2 mol/(L?s) |
| B、2 s时物质A的转化率为30% |
| C、用物质B表示的反应速率为0.6 mol/(L?s) |
| D、2 s时物质B的浓度为0.6 mol/L |
下列各组离子能大量共存且溶液颜色为无色的是( )
| A、Na+、MnO4-、K+、NO3-、SO32- |
| B、Na+、CO32-、Cl-、Al3+、NO3- |
| C、Na+、S2-、OH-、K+、Cl-、NO3- |
| D、Fe2+、H+、Na+、Ca2+、NO3- |
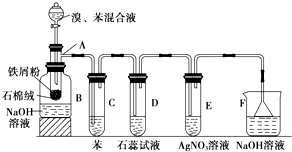 已知苯、溴和溴苯的物理性质如下表所示
已知苯、溴和溴苯的物理性质如下表所示