题目内容
2.A、B、C、D、E、F均为短周期元素.A的原子半径是短周期中最大的,B元素的原子最外层电子数为m,次外层电子数为n,C元素的原子L层电子数为 m+n,M层电子数为m-n,D元素与C元素同主族,E元素原子与B元素原子的核外电子数之比为2:1,F的一种原子中,质量数与质子数之差为0.(1)B2-的离子结构示意图为
 ;A、F两元素组成的化合物电子式为Na+[:H]-.
;A、F两元素组成的化合物电子式为Na+[:H]-.(2)A、B、E形成的简单离子的半径由大到小的顺序是S2->O2->Na+(用元素符号表示).
(3)由D、F可以构成最简单的化合物X,取356 g分子式为X•9H2O的化合物,将其释放的X完全燃烧生成液态水,可放出1 780.6 kJ的热量,则X燃烧的热化学方程式为CH4(g)+2O2(g)═CO2(g)+2H2O(l);△H=-890.3kJ/mol.
(4)1 mol DB2中含有的化学键的数目为4NA(NA为阿伏加德罗常数);DB2与某金属发生置换反应的化学方程式为2Mg+CO2$\frac{\underline{\;高温\;}}{\;}$2MgO+C;产物的一个用途是耐高温材料.
(5)向FeCl3溶液中通入过量的EB2,发生反应的离子方程式为2H2O+SO2+2Fe3+=2Fe2++SO42-+4H+.
分析 A的原子半径是短周期中最大的主族元素,则A为Na元素;F的一种原子中,质量数与质子数之差为零,则该原子中无中子,则F为H元素;B元素的原子最外层电子数为m,次外层电子数为n,则n为2或8;C元素的原子L层电子数为m+n,M层电子数为m-n,则L层含有8个电子,故n=2、m=6,B含有2个电子层,其最外层含有6个电子,B为O元素;C含有3个电子层,最外层含有6-2=4个电子,为Si元素;D元素与C元素同主族,则D为碳元素;E元素原子与B元素原子的核外电子数之比为2:1,则E电子数为16,为S元素,以此解答该题.
解答 解:A的原子半径是短周期中最大的主族元素,则A为Na元素;F的一种原子中,质量数与质子数之差为零,则该原子中无中子,则F为H元素;B元素的原子最外层电子数为m,次外层电子数为n,则n为2或8;C元素的原子L层电子数为m+n,M层电子数为m-n,则L层含有8个电子,故n=2、m=6,B含有2个电子层,其最外层含有6个电子,B为O元素;C含有3个电子层,最外层含有6-2=4个电子,为Si元素;D元素与C元素同主族,则D为碳元素;E元素原子与B元素原子的核外电子数之比为2:1,则E电子数为16,为S元素,
(1)B2-为氧离子,其核电荷数为8,核外电子总数为10,氧离子的离子结构示意图为: ;化合物AF为NaH,氢化钠为离子化合物,其电子式为:Na+[:H]-,
;化合物AF为NaH,氢化钠为离子化合物,其电子式为:Na+[:H]-,
故答案为: ;Na+[:H]-;
;Na+[:H]-;
(2)A为钠元素,B为氧元素,E为硫元素,三者的简单离子分别为Na+、O2-、S2-,Na+、O2-电子层排布相同,核电荷数越大离子半径越小,所以Na+<O2-,O2-、S2-最外层电子数相同,电子层越多离子半径越大,所以O2-<S2-,所以离子半径S2->O2->Na+,
故答案为:S2->O2->Na+;
(3)CH4•9H2O,n(CH4)=n(CH4•9H2O)=$\frac{356g}{178g/mol}$mol=2 mol,1 mol CH4燃烧放出热量为1 780.6 kJ÷2 mol=890.3 kJ/mol,故CH4燃烧的热化学方程式为:CH4(g)+2O2(g)═CO2(g)+2H2O(l);△H=-890.3 kJ/mol
故答案为:CH4(g)+2O2(g)═CO2(g)+2H2O(l);△H=-890.3kJ/mol;
(4)CO2的结构式为 故1 mol CO2含有4 mol化学键,化学键数为4NA.中学阶段常见的能与CO2发生置换反应的金属为Mg. MgO具有很高的熔点,常用于耐高温材料.
故1 mol CO2含有4 mol化学键,化学键数为4NA.中学阶段常见的能与CO2发生置换反应的金属为Mg. MgO具有很高的熔点,常用于耐高温材料.
故答案为:4;2Mg+CO2$\frac{\underline{\;高温\;}}{\;}$2MgO+C;耐高温材料;
(5)Fe3+具有较强的氧化性,SO2具有较强的还原性,Fe3+在水溶液中将SO2氧化成硫酸,本身被还原成Fe2+.方程式为2H2O+SO2+2Fe3+=2Fe2++SO42-+4H+,
故答案为:2H2O+SO2+2Fe3+=2Fe2++SO42-+4H+.
点评 本题考查了位置、结构与性质关系的综合应用,题目难度中等,涉及原电池原理、离子半径大小比较、离子方程式书写、常见化学用语的书写、元素推断等知识,注意掌握元素周期表结构、元素周期律内容,明确原子核外电子排布特点为解答关键.

 发散思维新课堂系列答案
发散思维新课堂系列答案| A. | NaHS | B. | Al2O3 | C. | NaHSO4 | D. | NaAlO2 |
| 容器 | SO2(mol) | O2(mol) | N(mol) | Q(kJ) |
| 甲 | 2 | 1 | 0 | Q1 |
| 乙 | 1 | 0.5 | 0 | Q2 |
| 丙 | 1 | 0.5 | 1 | Q3 |
| A. | 在上述条件下反应生成1molSO3气体放热98.5 kJ | |
| B. | Q1=2Q2=2Q3=197 kJ | |
| C. | 上述条件下1mol O2参加反应放出的热量为197 kJ/mol | |
| D. | Q2<Q3<Q1<197kJ |
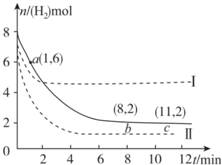 T℃时,6 mol CO2和 8 mol H2充入2 L密闭容器中,发生反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g),容器中H2的物质的量随时间的变化如图中实线所示.图中虚线表示仅改变某一反应条件时,H2的物质的量随时间的变化.下列说法正确的是( )
T℃时,6 mol CO2和 8 mol H2充入2 L密闭容器中,发生反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g),容器中H2的物质的量随时间的变化如图中实线所示.图中虚线表示仅改变某一反应条件时,H2的物质的量随时间的变化.下列说法正确的是( )| A. | 反应开始至a点时v(H2)=1 mol•L-1•min-1 | |
| B. | 若曲线Ⅰ对应的条件改变是升温,则该反应△H>0 | |
| C. | 曲线Ⅱ对应的条件改变是减少压强 | |
| D. | T℃时,该反应的化学平衡常数为0.125 |
| A. | 醋酸和足量的氢氧化钠溶液反应:H++OH-═H2O | |
| B. | 溴化亚铁溶液中通入足量的氯气:2 Fe2++4 Br-+3 Cl2═2 Fe3++2 Br2+6 Cl- | |
| C. | 用小苏打治疗胃酸过多:HCO3-+H+═CO2↑+H2O | |
| D. | 碳酸氢铵稀溶液中加入过量的石灰水:Ca2++HCO3-+2 OH-+NH4+═CaCO3↓+NH3•H2O+H2O |
| A. | 向铁粉中加入一定量的稀硝酸 | |
| B. | 向MgSO4,H2SO4的混合液中滴入过量Ba(OH)2溶液 | |
| C. | 向NaOH溶液中通入一定量CO2气体 | |
| D. | 将物质的量浓度之比为2:7的AlCl3和NaOH溶液等体积混合 |
| A. | 碳原子既可以跟自身,又可以跟其他原子(如氢原子)形成4个共价键 | |
| B. | 碳原子性质活泼,可以跟多数元素原子形成共价键 | |
| C. | 碳原子之间既可以形成稳定的单键,又可以形成稳定的双键和叁键 | |
| D. | 多个碳原子可以形成长度不同的链、支链及环,且链、环之间又可以相互结合 |
 所示.
所示.
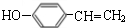 .
.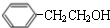 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$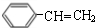 +H2O;C→D的反应类型为加成反应.
+H2O;C→D的反应类型为加成反应.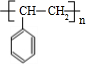 .
. )的叙述正确的是B(填字母序号)
)的叙述正确的是B(填字母序号)