题目内容
12.下列物质既能跟NaOH溶液作用,又能跟盐酸反应的是( )| A. | NaHS | B. | Al2O3 | C. | NaHSO4 | D. | NaAlO2 |
分析 中学常见既能与酸又能与碱反应的物质有:铝、两性氧化物、两性氢氧化物、弱酸酸式盐、弱酸的铵盐、氨基酸、蛋白质等.
解答 解:A.NaHS为弱酸酸式盐,能和稀盐酸、NaOH溶液反应,故A正确;
B.氧化铝属于两性氧化物,能和NaOH、HCl反应生成盐和水,故B正确;
C.硫酸氢钠是强酸强碱酸式盐,只能和NaOH反应,不能和稀盐酸反应,故C错误;
D.偏铝酸钠是强碱弱酸盐,能和稀盐酸反应,和NaOH不反应,故D错误;
故选AB.
点评 本题考查元素化合物性质,为高频考点,关键是元素化合物性质的掌握,注意归纳总结常见能与酸、碱反应的物质,题目难度不大.

练习册系列答案
相关题目
3.下列关系式或离子方程式中,正确的是( )
| A. | 常温下,将0.1 mol•L-1CH3COOH溶液加水稀释,当溶液的pH从3.0升到5.0时,溶液中$\frac{c({CH}_{3}C{OO}^{-})}{c({CH}_{3}COOH)}$的值增大到原来的100倍 | |
| B. | 向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液恰好使SO42-完全沉淀:NH4++Al3++2SO42-+2Ba2++5OH-═AlO2-+NH3•H2O+2BaSO4↓ | |
| C. | 常温下,0.1 mol•L-1Na2S溶液中存在:c(OH-)=c(H+)+c(HS-)+c(H2S) | |
| D. | 常温下,0.1 mol•L-1HA溶液与0.1 mol•L-1NaOH溶液恰好完全反应时,溶液中一定存在:c(Na+)=c(A-)>c(OH-)=c(H+) |
20.下列有机物命名正确的是( )
| A. | 3,3 二甲基丁烷 | B. | 2,2 二甲基丁烷 | ||
| C. | 2 乙基丁烷 | D. | 2,3,3 三甲基丁烷 |
7.下列叙述中正确的是( )
| A. | 含金属元素的离子都是阳离子 | |
| B. | 在氧化还原反应中,非金属单质一定是氧化剂,金属单质一定是还原剂 | |
| C. | 某元素从化合态变为游离态时,该元素一定被还原 | |
| D. | 金属阳离子被还原不一定得到金属单质 |
17.下列叙述正确的是( )
| A. | 甲苯、苯乙烯都既使酸性高锰酸钾褪色,也能使溴水褪色 | |
| B. | 塑料、橡胶和合成纤维都属于有机高分子化合物 | |
| C. | 肥皂是高级脂肪酸与甘油的酯化产物 | |
| D. | 石蜡是从石油中获取的油脂 |
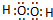 ,W第一步电离方程式为H2O2?H++HO2-.
,W第一步电离方程式为H2O2?H++HO2-. ;A、F两元素组成的化合物电子式为Na+[:H]-.
;A、F两元素组成的化合物电子式为Na+[:H]-.