题目内容
化学兴趣小组设计以下实验方案,测定某已部分变质的小苏打样品中Na2CO3的质量分数.
[方案一]
称取一定质量样品,置于坩锅中加热至恒重后,冷却,称量剩余固体质量,计算.
(1)坩锅中发生反应的化学方程式为:
(2)实验中,需加热至恒重的目的是 .
[方案二]
称取一定质量样品,置于小烧杯中,加适量水溶解;向小烧杯中加入足量Ba(OH)2溶液,过滤,洗涤、干燥沉淀,称量固体质量,计算.(已知:Ba2++OH-+HCO3-═BaCO3↓+H2O)
(1)过滤操作中,除了烧杯、漏斗外,还要用到的玻璃仪器为 .
(2)实验中判断沉淀是否完全的方法是 .
[方案三]
按如图所示装置进行实验:
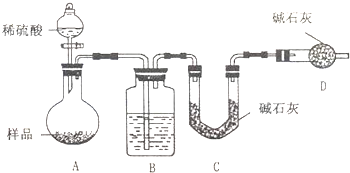
(1)D装置的作用是 .分液漏斗中 (填“能”或“不能”)用盐酸代替稀硫酸进行实验.
(2)实验前称取17.90g样品,实验后测得C装置增重8.80g,则样品中Na2CO3的质量分数为 .
(3)根 据 此 实 验 测 得 的 数 据,测 定 结 果 有 误 差,因 为 实 验装置还存在一个明显的缺陷是: .
[方案一]
称取一定质量样品,置于坩锅中加热至恒重后,冷却,称量剩余固体质量,计算.
(1)坩锅中发生反应的化学方程式为:
(2)实验中,需加热至恒重的目的是
[方案二]
称取一定质量样品,置于小烧杯中,加适量水溶解;向小烧杯中加入足量Ba(OH)2溶液,过滤,洗涤、干燥沉淀,称量固体质量,计算.(已知:Ba2++OH-+HCO3-═BaCO3↓+H2O)
(1)过滤操作中,除了烧杯、漏斗外,还要用到的玻璃仪器为
(2)实验中判断沉淀是否完全的方法是
[方案三]
按如图所示装置进行实验:

(1)D装置的作用是
(2)实验前称取17.90g样品,实验后测得C装置增重8.80g,则样品中Na2CO3的质量分数为
(3)根 据 此 实 验 测 得 的 数 据,测 定 结 果 有 误 差,因 为 实 验装置还存在一个明显的缺陷是:
考点:探究物质的组成或测量物质的含量,钠的重要化合物
专题:实验探究和数据处理题
分析:[方案一]碳酸氢钠不稳定,受热易分解,根据加热前后固体质量变化,根据差量法求碳酸氢钠的质量,进而求得碳酸钠的质量分数.
(1)碳酸氢钠受热分解生成碳酸钠、水和二氧化碳;
(2)加热恒重保证碳酸氢钠完全分解;
[方案二]碳酸钠和碳酸氢钠都和氢氧化钡反应生成碳酸钡沉淀,根据生成沉淀的质量来计算碳酸钠的质量分数.
(1)根据过滤操作考虑所需仪器;
(2)可取上层清液,继续加沉淀剂,看是否生成沉淀;
[方案三]由测定含量的实验可知,A中发生Na2CO3+H2SO4=H2O+CO2↑+Na2SO4、2NaHCO3+H2SO4=Na2SO4+2H2O+2CO2↑,B中为浓硫酸吸收水,干燥二氧化碳,利用C装置吸收二氧化碳,D装置防止空气中的二氧化碳、水进入C装置干扰含量测定,结合反应计算含量,以此来解答.
(1)碳酸氢钠受热分解生成碳酸钠、水和二氧化碳;
(2)加热恒重保证碳酸氢钠完全分解;
[方案二]碳酸钠和碳酸氢钠都和氢氧化钡反应生成碳酸钡沉淀,根据生成沉淀的质量来计算碳酸钠的质量分数.
(1)根据过滤操作考虑所需仪器;
(2)可取上层清液,继续加沉淀剂,看是否生成沉淀;
[方案三]由测定含量的实验可知,A中发生Na2CO3+H2SO4=H2O+CO2↑+Na2SO4、2NaHCO3+H2SO4=Na2SO4+2H2O+2CO2↑,B中为浓硫酸吸收水,干燥二氧化碳,利用C装置吸收二氧化碳,D装置防止空气中的二氧化碳、水进入C装置干扰含量测定,结合反应计算含量,以此来解答.
解答:
解:[方案一](1)碳酸氢钠受热分解生成碳酸钠、水和二氧化碳,反应方程式为:2NaHCO3
Na2CO3+H2O+CO2↑,故答案为:2NaHCO3
Na2CO3+H2O+CO2↑;
(2)实验原理是根据加热前后固体质量变化来计算碳酸氢钠,故应保证碳酸氢钠完全分解,加热恒重则碳酸氢钠完全分解,故答案为:保证NaHCO3分解完全;
[方案二](1)过滤时需用玻璃棒引流,故答案为:玻璃棒;
(2)可取上层清液,继续加沉淀剂,看是否生成沉淀,具体操作为:取上层清液少许于试管中,加入氢氧化钡溶液,若无沉淀生成,则沉淀完全,
故答案为:取少量上层清液于一支试管中,滴加Ba(OH)2溶液,观察是否有白色沉淀生成;
[方案三](1)空气中的水蒸气和二氧化碳会被碱石灰吸收,故D的作用是吸收空气中的水蒸气和二氧化碳,以确保C装置中质量增加量的准确性;分液漏斗中如果用盐酸代替硫酸,盐酸易挥发,这样制得二氧化碳气体中含氯化氢,浓硫酸不能吸收氯化氢,则氯化氢被碱石灰吸收,导致测到二氧化碳质量偏高,等质量碳酸钠和碳酸氢钠,碳酸氢钠产生二氧化碳多,则会导致碳酸氢钠偏多,碳酸钠偏小,
故答案为:防止空气中的水蒸气、二氧化碳进入C装置;不能;
(2)设NaHCO3和Na2CO3的物质的量分别为x、y,则
Na2CO3+H2SO4=H2O+CO2↑+Na2SO4、
x x
2NaHCO3+H2SO4=Na2SO4+2H2O+2CO2↑
y y
,解得
,
则样品中Na2CO3的质量分数为
×100%=29.6%,
故答案为:29.6%;
(3)实验装置还存在一个明显缺陷为装置中的二氧化碳不能被C全部吸收,则需设计一个装置将A、B中的CO2全部吹入C中吸收,
故答案为:缺少一个驱赶残留二氧化碳气体的装置.
| ||
| ||
(2)实验原理是根据加热前后固体质量变化来计算碳酸氢钠,故应保证碳酸氢钠完全分解,加热恒重则碳酸氢钠完全分解,故答案为:保证NaHCO3分解完全;
[方案二](1)过滤时需用玻璃棒引流,故答案为:玻璃棒;
(2)可取上层清液,继续加沉淀剂,看是否生成沉淀,具体操作为:取上层清液少许于试管中,加入氢氧化钡溶液,若无沉淀生成,则沉淀完全,
故答案为:取少量上层清液于一支试管中,滴加Ba(OH)2溶液,观察是否有白色沉淀生成;
[方案三](1)空气中的水蒸气和二氧化碳会被碱石灰吸收,故D的作用是吸收空气中的水蒸气和二氧化碳,以确保C装置中质量增加量的准确性;分液漏斗中如果用盐酸代替硫酸,盐酸易挥发,这样制得二氧化碳气体中含氯化氢,浓硫酸不能吸收氯化氢,则氯化氢被碱石灰吸收,导致测到二氧化碳质量偏高,等质量碳酸钠和碳酸氢钠,碳酸氢钠产生二氧化碳多,则会导致碳酸氢钠偏多,碳酸钠偏小,
故答案为:防止空气中的水蒸气、二氧化碳进入C装置;不能;
(2)设NaHCO3和Na2CO3的物质的量分别为x、y,则
Na2CO3+H2SO4=H2O+CO2↑+Na2SO4、
x x
2NaHCO3+H2SO4=Na2SO4+2H2O+2CO2↑
y y
|
|
则样品中Na2CO3的质量分数为
| 0.05mol×106g/mol |
| 17.90g |
故答案为:29.6%;
(3)实验装置还存在一个明显缺陷为装置中的二氧化碳不能被C全部吸收,则需设计一个装置将A、B中的CO2全部吹入C中吸收,
故答案为:缺少一个驱赶残留二氧化碳气体的装置.
点评:本题考查碳酸钠含量的测定实验,为高频考点,把握实验装置的作用及实验目的为解答的关键,侧重分析、计算及实验能力的综合考查,题目难度中等.

练习册系列答案
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案
相关题目
两种气态烃以任意比例混合,在105℃时1L该混合烃与3L氧气混合,充分燃烧后恢复到原状态,所得气体体积仍是4L.下列各组混合烃中符合此条件的是( )
| A、CH4、C2H4 |
| B、CH4、C3H6 |
| C、C2H4、C3H4 |
| D、C2H2、C3H6 |
下列物质,属于强电解质的是( )
| A、NH3?H2O |
| B、H2O |
| C、CH3COONH4 |
| D、CH3COOH |
在配制一定物质的量浓度的NaOH溶液时,下列仪器肯定不需要的是( )
A、 |
B、 |
C、 |
D、 |
下列属于酸性食物的是( )
| A、苹果 | B、柠檬 | C、鸡蛋 | D、菠菜 |
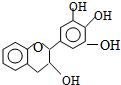 “茶倍健”牙膏中含有茶多酚,但茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂.其中没食子儿茶素(EGC)的结构如图.关于EGC的下列叙述中正确的是( )
“茶倍健”牙膏中含有茶多酚,但茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂.其中没食子儿茶素(EGC)的结构如图.关于EGC的下列叙述中正确的是( )| A、分子中所有的原子共面 |
| B、1mol EGC能与4mol NaOH反应 |
| C、可以发生氧化反应、取代反应、加成反应、消去反应 |
| D、能与FeCl3溶液发生显色反应 |

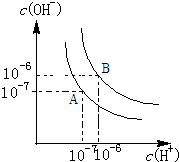 水的电离平衡如图所示.
水的电离平衡如图所示.